রসায়ন চতুর্থ অধ্যায় নোট
পর্যায় সারণি
Periodic Table
পাঠ সম্পর্কিত গুরুত্বপূর্ণ বিষয়াদি
- পর্যায় সারণি : বিভিন্ন মৌলের ক্রমপরিবর্তন দেখানোর প্রয়াসে মৌলসমূহকে যে সারণিতে সাজানো হয়, তাকে পর্যায় সারণি বলা হয়। 1789 সালে বিজ্ঞানী ল্যাভয়শিয়ে ভৌত অবস্থার উপর ভিত্তি করে, 1864 সালে ইংরেজ বিজ্ঞানী জন নিউল্যান্ড মৌলসমূহের ভর অনুযায়ী, 1869 সালে রুশ বিজ্ঞানী ডিমিট্রি ম্যান্ডেলিফ পারমাণবিক ভর অনুসারে ও 1913 সালে বিজ্ঞানী হেনরি মোসলে পারমাণবিক সংখ্যার উপর ভিত্তি করে পর্যায় সারণি প্রস্তাব করেছেন যা নানা পরিবর্তনের মধ্য দিয়ে বর্তমান পর্যায় সারণির রূপ লাভ করেছে।
- পর্যায় : পর্যায় সারণির আনুভূমিক সারিগুলোকে পর্যায় বা Period বলে। বর্তমান পর্যায় সারণিতে মোট ৭টি পর্যায় আছে। প্রতিটি পর্যায়ের মৌলগুলোর ধর্ম অভিন্ন তবে ক্রমপরিবর্তনশীল হয়। যেমন-একই পর্যায়ে যতই ডানদিক যাওয়া যায়, ততই মৌলসমূহের মধ্যে ধাতুধর্ম হ্রাস পায় ও পরমাণুর আকার ছোট হয়।
- শ্রেণি বা গ্রুপ : পর্যায় সারণির লম্ব স্তম্ভগুলোকে বা উল্লম্ব সারিগুলোকে শ্রেণি বা Group বলে। সদৃশ ধর্মের মৌলগুলো একটি শ্রেণিতে স্থান পায়। বর্তমান পর্যায় সারণিতে মোট 18টি গ্রুপ আছে। আগে পর্যায় সারণির এ 18টি গ্রুপকে রোমান হরফের সংখ্যা I থেকে VIII দ্বারা প্রকাশ করা হতো। সপ্তম শ্রেণির পরের শ্রেণিকে শূন্য শ্রেণি বলা হতো। পূর্বের এ শ্রেণিকরণকে সর্বশেষ পর্যায় সারণির সংস্করণে 18টি গ্রুপে ভাগ করে পুনর্বিন্যাস করা হয়েছে যা IUPAC কর্তৃক গৃহীত হয়েছে।
এসএসসি সকল বিষয়ে সাজেশন পেতে এখানে ক্লিক করুন
- ডোবেরাইনারের ত্রয়ীসূত্র : রাসায়নিক ধর্মের সাদৃশ্য আছে এরকম তিনটি মৌলের মধ্যবর্তী মৌলটির পারমাণবিক ভর, অন্য দুটি মৌলের পারমাণবিক ভরের গড় মানের সমান হয়। যেমন Li, Na এবং K মৌল তিনটির মধ্যে রাসায়নিক ধর্মের মিল আছে।
Li এবং K-এর পারমাণবিক ভর যথাক্রমে 7 এবং 39 ।
(7+ 39)/2 = 46/2 = 23
অতএব Na-এর পারমাণবিক ভর 23।
কিন্তু সূত্রটি খুব কমসংখ্যক মৌলের ক্ষেত্রে প্রযোজ্য হওয়ায় বিশেষ গুরুত্ব লাভ করতে পারেনি। এরপর 1864 সালে ইংরেজ বিজ্ঞানী জন নিউল্যান্ড তার বিখ্যাত অষ্টক তত্ত্ব প্রকাশ করেন।
- নিউল্যান্ডের অষ্টক তত্ত্ব : মৌলগুলোকে ক্রমবর্ধমান পারমাণবিক ভর অনুসারে সাজালে কোনো একটি মৌলের ধর্মের সাথে পরবর্তী অষ্টম মৌলের ধর্মের সাদৃশ্য দেখা যাবে। এটি অষ্টক তত্ত্ব নামে পরিচিত। যেমন : Li(7), Be (9.02), B (10.8), C(12), N(14), O(16), F(19), Na(23), Mg(24)। এক্ষেত্রে Li থেকে শুরু করে অষ্টম মৌল Na-এর ধর্মের এবং Be থেকে শুরু করে অষ্টম মৌল Mg-এর ধর্মের সাদৃশ্য রয়েছে। এভাবে প্রথম দিকের কতগুলো মৌলের ক্ষেত্রে এ সূত্র প্রযোজ্য হলেও Ca(20) -পরবর্তী মৌলগুলোর ক্ষেত্রে এ সূত্র খাটে না।
- ম্যান্ডেলিফের পর্যায় সূত্র : 1869 সালে রাশিয়ান রসায়নবিদ ডিমিট্রি ম্যান্ডেলিফ আবিষ্কৃত মৌলসমূহের পারমাণবিক ভরকে ভিত্তি ধরে পর্যায় সারণিতে উচ্চক্রমানুসারে সাজিয়ে দেখেন একই ধর্মবিশিষ্ট মৌলসমূহ একই কলামে স্থান পায়। তাই তিনি এভাবে সন্নিবেশিত মৌলসমূহের ক্ষেত্রে একটি সূত্র প্রতিষ্ঠা করেন। সূত্রটি ছিল :
“যদি মৌলসমূহকে ক্রমবর্ধমান পারমাণবিক ভর অনুসারে সাজানো হয়, তবে তাদের ভৌত ও রাসায়নিক ধর্মাবলি পর্যায়ক্রমে আবর্তিত হয়।”
1913 সালে বিজ্ঞানী হেনরি মোসলে পারমাণবিক সংখ্যা আবিষ্কারের পর ম্যান্ডেলিফ তার পর্যায় সূত্র সংশোধন করেন। ম্যান্ডেলিফের সংশোধিত পর্যায় সূত্র হলো, “মৌলসমূহের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক সংখ্যা অনুসারে পর্যায়ক্রমে আবর্তিত হয়।“ এই পর্যায় সূত্রটিই আধুনিক পর্যায় সারণির ভিত্তি। এ কারণে ম্যান্ডেলিফকে পর্যায় সারণির জনক বলা হয়।
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
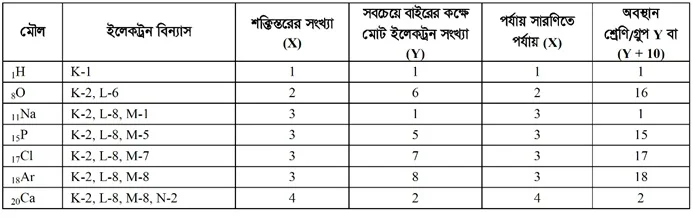
- পর্যায় সারণির ভিত্তি : পর্যায় সারণি সৃষ্টির সময় মৌলসমূহের পারমাণবিক ভরকে ভিত্তি ধরা হয়েছিল। পরবর্তীতে পারমাণবিক সংখ্যাকে ভিত্তি ধরা হয়। বর্তমানে একথা স্বীকৃত যে পর্যায় সারণির সত্যিকার ভিত্তি হচ্ছে মৌলসমূহের ইলেকট্রন বিন্যাস। প্রতিনিধিত্বমূলক মৌলসমূহের ইলেকট্রন বিন্যাসে সর্বশেষ স্তরে যতটি ইলেকট্রন বিদ্যমান, তা থেকে পর্যায় সারণিতে মৌলটির অবস্থান কত নম্বর গ্রুপে তা হিসাব করা যায়। আর ইলেকট্রন বিন্যাসে যতটি স্তর আছে মৌলটির অবস্থান তত নম্বর পর্যায়ে।
- পরমাণুর ইলেকট্রন বিন্যাস থেকে পর্যায় সারণিতে কয়েকটি মৌলের অবস্থান নির্ণয় : সাধারণভাবে কোনো মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ শক্তিস্তরে যে কয়টি ইলেকট্রন থাকে, মৌলটির অবস্থান তত নম্বর গ্রুপে হয়। তবে দুইটি ও তিনটি শক্তিস্তরে বিন্যস্ত যে সকল মৌলের সর্বশেষ কক্ষপথে দুটির বেশি ইলেকট্রন থাকে তাদের ক্ষেত্রে সর্ববহিঃস্থ শক্তিস্তরে উপস্থিত ইলেকট্রন সংখ্যার সাথে দশ (10) যোগ করে গ্রুপ সংখ্যা নির্ণয় করা হয়। আবার, সবশেষ কক্ষপথে ৪টি ইলেকট্রন থাকলে সেই মৌল গ্রুপ-18 তে স্থান পায়।
নিচে একটি ছকের মাধ্যমে কিছু উদাহরণ দেখানো হলো :
- ভৌত ধর্মের সাদৃশ্য : পর্যায় সারণিতে বিভিন্ন মৌলের ঘনত্ব, গলনাঙ্ক, ফুটনাঙ্ক, তাপ ও তড়িৎ পরিবহন ক্ষমতা ইত্যাদি ভৌত ধর্মগুলোর পর্যায়বৃত্তি দেখা যায়। পর্যায় সারণির একই পর্যায়ে কঠিন মৌলগুলোর ঘনত্ব পারমাণবিক ভর বাড়ার সঙ্গে সঙ্গে বাড়তে থাকে তারপর আবার কমতে থাকে। একই পর্যায়ে বামদিক থেকে ডানদিকে গেলে ধাতব গুণ কমতে থাকে, ফলে তড়িৎ পরিবাহিতা ক্রমশ হ্রাস পায়। অপরদিকে একই গ্রুপে যত উপর থেকে নিচে যাওয়া যায়, মৌলসমূহের ধাতু ধর্ম তত বৃদ্ধি পায়।
- রাসায়নিক ধর্মে সাদৃশ্য : পর্যায় সারণির একই শ্রেণির মৌলগুলোর রাসায়নিক ধর্ম একরকম হয়। যেমন : 1 গ্রুপের Li, Na, K, Rb এবং Cs এর রাসায়নিক ধর্মে অনেক মিল দেখা যায়। আবার, 17 গ্রুপের F, Cl, Br এবং I এর মধ্যে রাসায়নিক ধর্মে খুবই সাদৃশ্য আছে। সাধারণভাবে দেখা যায় একই শ্রেণির উপর থেকে যত নিচের দিকে যাওয়া যায়, মৌলগুলোর রাসায়নিক ধর্ম নিয়মিতভাবে তত বাড়ে বা কমে।
- ক্ষার ধাতু : পর্যায় সারণিতে গ্রুপ-এ অবস্থিত মৌলসমূহ যেমন : Li, Na, K, Rb, Cs এবং Fr কে ক্ষার ধাতু (alkali metal) বলা হয়। এরা প্রত্যেকেই পানির সাথে বিক্রিয়া করে হাইড্রোজেন গ্যাস ও ক্ষার দ্রবণ তৈরি করে। এরা সর্ববহিঃস্থ শক্তিস্তরে অবস্থিত একমাত্র ইলেকট্রনটি প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে।
- মৃৎক্ষার ধাতু : গ্রুপ-2-এ অবস্থিত Be থেকে শুরু করে Ra পর্যন্ত মৌলসমূহকে মৃৎক্ষার ধাতু বলা (alkaline earth metal) হয়। এদের ধর্ম অনেকটা ক্ষার ধাতুর মতোই। এদের অক্সাইডসমূহ পানিতে ক্ষারীয় দ্রবণ তৈরি করে। এরাও সর্ববহিঃস্থ শক্তিস্তরের 2টি ইলেকট্রন প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে। এই মৌলসমূহ বিভিন্ন যৌগ হিসেবে মাটিতে থাকে।
- অবস্থান্তর মৌল : পর্যায় সারণিতে গ্রুপ-3 থেকে গ্রুপ-11 পর্যন্ত গ্রুপে অবস্থিত মৌলসমূহ অবস্থান্তর মৌল (transition metal) হিসেবে পরিচিত। অবস্থান্তর মৌলসমূহের নিজস্ব বর্ণ রয়েছে। এরা ধাতব পদার্থ হিসেবে প্রচর ব্যবহূত হয়। সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন প্রদান করে আয়নিক যৌগ তৈরি করে। কোনো পর্যায়ের অবস্থান্তর মৌলসমূহের মধ্যে বামদিকের মৌল থেকে ডানদিকের মৌল দ্বারা গঠিত যৌগের বৈশিষ্ট্য আয়নিক থেকে সমযোজীতে পরিবর্তিত হয়।
- মুদ্রা ধাতু : পর্যায় সারণিতে গ্রুপ-11-তে অবস্থিত মৌল-তামা (Cu), রুপা (Ag) ও সোনা (Au) এদের ধাতব বৈশিষ্ট্যসহ উজ্জ্বলতা বিদ্যমান। ঐতিহাসিকভাবে এসব ধাতু দ্বারা মুদ্রা তৈরি করে তাদেরকে ক্রয়-বিক্রয় ও অন্যান্য প্রয়োজনে বিনিময়ের মাধ্যম হিসেবে ব্যবহার করা হয়। এদেরকে মুদ্রা ধাতু (coinage metals) বলা হয়। প্রকৃতপক্ষে এরা অবস্থান্তর মৌল।
- হ্যালোজেন : গ্রুপ-17 তে অবস্থিত মৌল F, CI, Br, I ও At এই 5টি মৌলকে একত্রে হ্যালোজেন (halogen) বলে। হ্যালোজেন শব্দের অর্থ লবণ গঠনকারী (salt maker)। এরা সর্ববহিঃস্থ শক্তিস্তরে একটি ইলেকট্রন গ্রহণের মাধ্যমে হ্যালাইড আয়ন তৈরি করে। হ্যালোজেনসমূহের মূল উৎস সামুদ্রিক লবণ। এরা নিজে নিজেই ইলেকট্রন ভাগাভাগির (electron sharing) মাধ্যমে দ্বি-মৌল অণু তৈরি করে।
- নিষ্ক্রিয় গ্যাস : পর্যায় সারণিতে গ্রুপ-18-তে অবস্থিত মৌলসমূহকে নিষ্ক্রিয় মৌল বলে। কারণ এদের সর্ববহিঃস্থ শক্তিস্তর প্রয়োজনীয় সংখ্যক ইলেকট্রন দ্বারা পূর্ণ থাকায় এরা ইলেকট্রন আদান-প্রদান বা শেয়ারের মাধ্যমে সাধারণত যৌগ গঠন করে না।
বাংলা দ্বিতীয় পত্র বহুনির্বাচনি প্রশ্নোত্তর পেতে এখানে ক্লিক করুন
- পরমাণুর আকার : পরমাণুর আকার একটি পর্যায়বৃত্ত ধর্ম। যে কোনো পর্যায়ে বামদিক থেকে ডানদিকে পরমাণুর আকার হ্রাস পায় এবং একই গ্রুপে উপর থেকে নিচের দিকে পারমাণবিক আকার বৃদ্ধি পায়।
- আয়নিকরণ শক্তি : একই পর্যায়ে বামদিক থেকে ডানদিকে মৌলসমূহের আয়নিকরণ শক্তি হ্রাস পায়।
- অপধাতু বা উপধাতু : যে মৌলের ধাতু ও অধাতু উভয় ধরনের বৈশিষ্ট্য রয়েছে তাকে অপধাতু বা উপধাতু বলা হয়। যেমন : বোরন (B), সিলিকন (si), আর্সেনিক (As), টেলুরিয়াম (Te) ইত্যাদি।
- সক্রিয় ধাতু ও অধাতু : পর্যায় সারণির সর্ববামের ধাতুগুলো সক্রিয় ধাতু। যেমন : Na, K ইত্যাদি। অন্যদিকে, পর্যায় সারণির ডানদিক থেকে ২য় গ্রুপে রয়েছে সক্রিয় অধাতু। যেমন, F, Cl ইত্যাদি।
- রাসায়নিক ক্রিয়াশীলতা : পর্যায় সারণির বামদিকের গ্রুপগুলোর উপর থেকে যত নিচের দিকে নামা যায়, মৌলগুলোর রাসায়নিক সক্রিয়তা তত বাড়তে থাকে। কিন্তু পর্যায় সারণির ডানদিকে অবস্থিত একই গ্রুপের মৌলগুলোর ক্ষেত্রে উপর থেকে যত নিচের দিকে নামা যায়, মৌলগুলোর রাসায়নিক সক্রিয়তা তত কমতে থাকে। যেমন, 17 গ্রুপের হ্যালোজেন মৌলগুলোর মধ্যে F-এর সক্রিয়তা সবচেয়ে বেশি এবং I-এর সক্রিয়তা সবচেয়ে কম।
জ্ঞানমূলক প্রশ্ন ও উত্তর
প্রশ্ন ॥ ১ ॥ আধুনিক পর্যায় সারণিতে কয়টি গ্রুপ আছে?
উত্তর : আধুনিক পর্যায় সারণিতে মোট 18টি গ্রুপ বা শ্রেণি আছে।
প্রশ্ন ॥ ২॥ পর্যায় সারণির উদ্ভাবক কে?
উত্তর : পর্যায় সারণির উদ্ভাবক রুশ বিজ্ঞানী ডিমিট্রি ম্যান্ডেলিফ।
প্রশ্ন ॥ ৩ ॥ ম্যান্ডেলিফের পর্যায় সারণির ভিত্তি কী ছিল?
উত্তর : ম্যান্ডেলিফের পর্যায় সারণির ভিত্তি ছিল মৌলসমূহের পারমাণবিক ভর।
প্রশ্ন ॥ ৪ ॥ পর্যায় সারণির তৃতীয় পর্যায়ের প্রথম মৌলের নাম কী?
উত্তর : পর্যায় সারণির তৃতীয় পর্যায়ের প্রথম মৌলের সোডিয়াম।
প্রশ্ন ॥ ৫॥ হ্যালোজেনগুলো পর্যায় সারণিতে কোন শ্রেণিতে অবস্থান করে?
উত্তর : হ্যালোজেনগুলো পর্যায় সারণিতে 17 নং শ্রেণিতে অবস্থান করে।
প্রশ্ন ॥ ৬ ॥ পর্যায় সারণির দ্বিতীয় পর্যায়ের মৌলগুলোর মধ্যে কোনগুলো ধাতু আর কোনগুলো অধাতু?
উত্তর : পর্যায় সারণির দ্বিতীয় পর্যায়ে মোট আটটি মৌল আছে। যেমন-Li, Be, B, C, N, O, F এবং Ne । এ পর্যায়ের মৌলগুলোর মধ্যে Li এবং Be ধাতু, বাকি সবগুলো অধাতু।
প্রশ্ন ॥ ৭ ॥ পর্যায় সারণির তৃতীয় পর্যায়ে কয়টি মৌল আছে?
উত্তর : পর্যায় সারণির তৃতীয় পর্যায়ে আটটি মৌল আছে।
প্রশ্ন ॥ ৮ ॥ পর্যায় সারণির সবচেয়ে ছোট পর্যায় কোনটি?
উত্তর : পর্যায় সারণির প্রথম পর্যায় সবচেয়ে ছোট।
এসএসসি সকল বিষয় সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন ॥ ৯ ॥ পর্যায় সারণির পঞ্চম পর্যায়ে কয়টি মৌল আছে?
উত্তর : পর্যায় সারণির পঞ্চম পর্যায়ে 18টি মৌল আছে।
প্রশ্ন ॥ ১০ ॥ ক্ষার ধাতু কাদের বলা হয়?
উত্তর : পর্যায় সারণির 1 শ্রেণির মৌলসমূহকে ক্ষার ধাতু বলা হয়।
প্রশ্ন ॥ ১১ ॥ নাইট্রোজেন পর্যায় সারণির কোন গ্রুপে অবস্থিত?
উত্তর : নাইট্রোজেন পর্যায় সারণির 15 গ্রুপে অবস্থিত।
প্রশ্ন ॥ ১২ ॥ পারমাণবিক সংখ্যা কী?
উত্তর : কোনো মৌলের প্রোটন সংখ্যাকে তার পারমাণবিক সংখ্যা বলে।
প্রশ্ন ॥ ১৩ ॥ পর্যায় সংখ্যা কী?
উত্তর : কোনো মৌলের যতটি শক্তিস্তরে ইলেকট্রন বিন্যাস থাকে, শক্তিস্তরের সে সংখ্যাই হলো পর্যায় সংখ্যা।
প্রশ্ন ॥ ১৪ ॥ নিকৃষ্ট ধাতু কোনগুলো?
উত্তর : অধিক সক্রিয় ধাতু (যেমন- লোহা, দস্তা প্রভৃতি) কে নিকৃষ্ট ধাতু (inferior metals) বলে।
প্রশ্ন ॥ ১৫ ॥ গ্রুপ সংখ্যা কী?
উত্তর : সাধারণভাবে সর্ববহিঃস্থ শক্তিস্তরে অবস্থিত (কিছু ব্যতিক্রম ব্যতীত) ইলেকট্রন সংখ্যাই কোনো নির্দিষ্ট পর্যায়ে উক্ত মৌলের গ্রুপ সংখ্যা।
প্রশ্ন ॥ ১৬ ॥ ক্ষার ধাতু পানির সাথে কীরূপ বিক্রিয়া দেখায়?
উত্তর : ক্ষার ধাতু পানির সাথে বিক্রিয়া করে হাইড্রোজেন গ্যাস ও ক্ষার দ্রবণ তৈরি করে।
প্রশ্ন ॥ ১৭ ॥ হ্যালোজেন কী?
উত্তর : গ্রুপ-17 তে অবস্থিত মৌল- F, CI, Br, I এবং At এই 5টি মৌলকে একত্রে হ্যালোজেন বলে।
প্রশ্ন ॥ ১৮ ॥ হ্যালোজেনসমূহের মূল উৎস কী?
উত্তর : হ্যালোজেনসমূহের মূল উৎস সামুদ্রিক লবণ।
প্রশ্ন ॥ ১৯ ॥ কোনটি ব্যতীত রসায়ন চর্চা অসম্ভব?
উত্তর : পর্যায় সারণি ব্যবহার ব্যতীত বর্তমান যুগে রসায়ন চর্চা অবসম্ভব।
জীববিজ্ঞান দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন ॥ ২০ ॥ সিলিকন কী ধরনের মৌল?
উত্তর : সিলিকন এক ধরনের অপধাতব মৌল, যেটি ধাতু ও অধাতু উভয়ের বৈশিষ্ট্য বহন করে।
অনুধাবনমূলক প্রশ্ন ও উত্তর
প্রশ্ন ॥ ১ ॥ পর্যায় সারণির একইগ্রুপে মৌলগুলোর ধর্ম একইরকমের হয় কেন?
উত্তর : একই গ্রুপের মৌলসমূহের ইলেকট্রন বিন্যাস একই রকম হয় বলে তাদের ভৌত ও রাসায়নিক ধর্ম একই রকম হয়। মৌলসমূহের ইলেকট্রন বিন্যাসের ওপর তাদের রাসায়নিক এবং ভৌত ধর্ম নির্ভর করে। যেহেতু একই গ্রুপের মৌলসমূহের পরমাণুতে সর্ব বহিঃস্থ শক্তিস্তরের ইলেকট্রন বিন্যাস একই রকমের হয়, তাই তাদের ভৌত ও রাসায়নিক ধর্ম একই রকমের হয়।
প্রশ্ন ॥ ২॥ পর্যায় সারণির উপকারিতা কী?
উত্তর : পর্যায় সারণির উপকারিতা নিম্নরূপ :
১. সদৃশধর্মী মৌলগুলো পর্যায় সারণির একই শ্রেণির অন্তর্ভুক্ত হওয়ায় কোনো একটি মৌলের ধর্ম এবং এর যৌগগুলোর ধর্ম জানা থাকলে অন্যান্য মৌলগুলোর ধর্ম এবং তাদের যৌগগুলোর ধর্ম সম্বন্ধে ধারণা পাওয়া যায়।
২. মৌলগুলোর ভৌত ও রাসায়নিক ধর্ম তাদের পারমাণবিক সংখ্যা বাড়ার সঙ্গে সঙ্গে পর্যায়ক্রমে পুনরাবৃত্ত হয়। তাই পর্যায় সারণিতে কোনো মৌলের অবস্থান জানা থাকলে ঐ মৌলটির বিভিন্ন ধর্ম যেমন- গলনাঙ্ক বা স্ফুটনাঙ্ক, রাসায়নিক সক্রিয়তা, ধাতব এবং অধাতব ধর্ম ইত্যাদি অনুমান করা যায়।
প্রশ্ন ॥ ৩॥ Cu মৌলটি পর্যায় সারণির কোথায় বসবে?
উত্তর : যেহেতু মৌলটির পারমাণবিক সংখ্যা 29, অতএব মৌলটির ইলেকট্রন বিন্যাস 2, 8, 18, 1। এখানে মোট শক্তিস্তরের সংখ্যা 4, তাই মৌলটি পর্যায় সারণিতে চতুর্থ পর্যায়ে অবস্থান করে। আবার মৌলটির সবচেয়ে বাইরের কক্ষে একটিমাত্র ইলেকট্রন আছে। অতএব, মৌলটি পর্যায় সারণির 11 গ্রুপভুক্ত মৌল।
প্রশ্ন ॥ ৪ ॥ পর্যায় সারণির যেকোনো পর্যায়ের মৌলসমূহের পারমাণবিক আকার কীভাবে পরিবর্তিত হয়?
উত্তর : যে কোনো পর্যায়ে যতই ডানদিকে যাওয়া যায়, অর্থাৎ পারমাণবিক সংখ্যা যতই বাড়ে, পরমাণুর আকার ততই হ্রাস পায়। এর কারণ হচ্ছে একই পর্যায় পারমাণবিক সংখ্যা বৃদ্ধির সঙ্গে সঙ্গে একটি করে ইলেকট্রন যুক্ত হয়, কিন্তু ইলেকট্রনের স্তর সংখ্যা বাড়ে না। পারমাণবিক সংখ্যা বৃদ্ধির অর্থ নিউক্লিয়াসে ধনাত্মক আধানের বৃদ্ধি। ফলে ইলেকট্রনসমূহ নিউক্লিয়াস কর্তৃক আরো জোরে আকৃষ্ট হয়। এতে পরমাণুর ব্যাসার্ধ হ্রাস পায়।
প্রশ্ন ॥ ৫॥ অ্যাক্টিনাইডস বলতে কী বোঝ?
উত্তর : পর্যায় সারণির সপ্তম পর্যায়ের 3নং গ্রুপে Ac এর পর Th থেকে Lr পর্যন্ত 15টি মৌল আছে। এ মৌলগুলোকে অ্যাক্টিনাইডস বলে। এ মৌলগুলোর মধ্যে Ac, Th, Pa, U প্রকৃতিতে পাওয়া যায়। বাকি মৌলগুলো কৃত্রিমভাবে পরীক্ষাগারে তৈরি করা হয়েছে। এ পর্যায়ের মৌলগুলো তেজস্ক্রিয়।
প্রশ্ন ॥ ৬ ॥ পর্যায় সারণিতে নিষ্ক্রিয় গ্যাসগুলোর একই গ্রুপ অবস্থানের পক্ষে যুক্তি দেখাও।
উত্তর : He, Ne, Ar, Kr, Xe এবং Rn-এ 6টি নিষ্ক্রিয় গ্যাস। এদের ধর্মের মধ্যে অনেক মিল আছে। যেমন :
১. সকল মৌলগুলো গ্যাসীয় এবং এক পরমাণুক।
২. এরা সহজে কোনো রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না। তাই এদের যোজনী শূন্য এবং এদের নিষ্ক্রিয় মৌল বলে।
৩. He ছাড়া সব গ্যাসের পরমাণুর সবচেয়ে বাইরের কক্ষে ৪টি ইলেকট্রন আছে। একমাত্র He পরমাণুর ক্ষেত্রে বাইরের কক্ষে 2টি ইলেকট্রন থাকে। অতএব, যুক্তিসঙ্গত কারণেই পর্যায় সারণিতে নিষ্ক্রিয় গ্যাসগুলো একই গ্রুপে অবস্থান করে।
প্রশ্ন ॥ ৭ ॥ অবস্থান্তর মৌলের দুইটি প্রধান বৈশিষ্ট্য লিখ।
উত্তর : অবস্থান্তর মৌলের প্রধান দুইটি বৈশিষ্ট্য নিম্নরূপ-
i. অবস্থান্তর মৌলসমূহের নিজস্ব বর্ণ রয়েছে।
ii. অবস্থান্তর মৌলসমূহ ধাতব পদার্থের ন্যায় সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন প্রদান করে আয়নিক যৌগ তৈরি করে।
প্রশ্ন ॥ ৮ ॥ পর্যায় সারণির সুবিধাগুলো কী কী?
উত্তর : রসায়নশাস্ত্র অধ্যয়ন ও প্রয়োগকারীদের জন্য পর্যায় সারণি একটি অপরিহার্য হাতিয়ার। পর্যায় সারণিতে সন্নিবেশিত মৌলের অবস্থানের মাধ্যমে তার ভৌত ও রাসায়নিক ধর্ম সম্পর্কে আমরা সহজেই ধারণা করতে পারি। বাহ্যিক দিক থেকে পর্যায় সারণিতে ছকে মৌলসমূহকে সন্নিবেশ করা হয়েছে মনে হলেও বাস্তবে এর তাৎপর্য অপরিসীম।
রসায়ন দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন ॥ ৯ ॥ গাঢ় H2SO4 কে নিরুদক বলা হয় কেন?
উত্তর : গাঢ় H2SO4 এর সাথে পানি মেশালে প্রচুর তাপ নির্গত হয়। পানির প্রতি গাঢ় H2SO4-এর প্রবল আসক্তির কারণে তা বিভিন্ন যৌগ হতে পানি বের করে নিতে পারে। এজন্য, গাঢ় H2SO4 কে নিরুদক বলা হয়।
প্রশ্ন ॥ ১০ ॥ গ্রুপ-1 এর মৌলসমূহ একযোজী কেন?
উত্তর : গ্রুপ-1 এর মৌলগুলোর সর্ববহিঃস্থ স্তরে একটি ইলেকট্রন থাকায় এরা একযোজী। গ্রুপ-1 এর ক্ষারধাতুগুলোর সর্ববহিঃস্থ স্তরে একটি করে ইলেকট্রন থাকায় রাসায়নিক বিক্রিয়ার সময় এরা 1টি ইলেকট্রন দান করে নিস্ক্রিয় গ্যাসের স্থিতিশীল ইলেকট্রন বিন্যাস লাভ করে। এজন্য, গ্রুপ-1 এর মৌলসমূহ একযোজী।
প্রশ্ন ॥ ১১ ॥ ক্ষার ধাতু বলতে কী বুঝ?
উত্তর : ক্ষার ধাতু : পর্যায় সারণিতে গ্রুপ-1এ অবস্থিত মৌলসমূহ যেমন : Li, Na, K, Rb, Cs এবং Fr কে ক্ষার ধাতু (alkali metal) বলা হয়। এরা প্রত্যেকেই পানির সাথে বিক্রিয়া করে হাইড্রোজেন গ্যাস ও ক্ষার দ্রবণ তৈরি করে। এরা সর্ববহিঃস্থ শক্তিস্তরে অবস্থিত একমাত্র ইলেকট্রনটি প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে।
প্রশ্ন ॥ ১২ ॥ মৃৎক্ষার ধাতু বলতে কী বুঝ?
উত্তর : মৃৎক্ষার ধাতু : গ্রুপ-2-এ অবস্থিত Be থেকে শুরু করে Ra পর্যন্ত মৌলসমূহকে মৃৎক্ষার ধাতু বলা (alkaline earth metal) হয়। এদের ধর্ম অনেকটা ক্ষার ধাতুর মতোই। এদের অক্সাইডসমূহ পানিতে ক্ষারীয় দ্রবণ তৈরি করে। এরাও সর্ববহিঃস্থ শক্তিস্তরের 2টি ইলেকট্রন প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে। এই মৌলসমূহ বিভিন্ন যৌগ হিসেবে মাটিতে থাকে।
প্রশ্ন ॥ ১৩ ॥ অবস্থান্তর মৌল বলতে কী বুঝ?
উত্তর : অবস্থান্তর মৌল : পর্যায় সারণিতে গ্রুপ-3 থেকে গ্রুপ-11 পর্যন্ত গ্রুপে অবস্থিত মৌলসমূহ অবস্থান্তর মৌল (transition metal) হিসেবে পরিচিত। অবস্থান্তর মৌলসমূহের নিজস্ব বর্ণ রয়েছে। এরা ধাতব পদার্থ হিসেবে প্রচুর ব্যবহৃত হয়। সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন প্রদান করে আয়নিক যৌগ তৈরি করে। কোনো পর্যায়ের অবস্থান্তর মৌলসমূহের মধ্যে বামদিকের মৌল থেকে ডানদিকের মৌল দ্বারা গঠিত যৌগের বৈশিষ্ট্য আয়নিক থেকে সমযোজীতে পরিবর্তিত হয়।
প্রশ্ন ॥ ১৪ ॥ বেরিয়ামকে মৃৎক্ষার বলা হয় কেন?
উত্তর : বেরিয়ামকে মৃৎক্ষার বলার কারণ- যে সকল ধাতু মাটিতে যৌগ হিসেবে পাওয়া যায় এবং পানির সাথে বিক্রিয়া করে ক্ষার তৈরি করে তাদেরকে মৃৎক্ষার ধাতু বলা হয়। বৈশিষ্ট্য অনুসারে গ্রুপ-2 এর মৌলসমূহকে মৃৎক্ষার ধাতু বলা হয়। বেরিয়াম ( Ba) মৌলটি পর্যায় সারণির দ্বিতীয় গ্রুপে অবস্থিত। মৌলটি মূলত মাটিতে পাওয়া যায় এবং পানির সাথে বিক্রিয়া করে ক্ষার [Ba(OH)2] তৈরি করে। অর্থাৎ বেরিয়ামে মৃৎক্ষার ধাতুর সব বৈশিষ্ট্য বিদ্যমান। তাই বেরিয়ামকে মৃৎক্ষার ধাতু বলা হয়।
প্রশ্ন ॥ ১৫ ॥ কোন মৌলের ইলেকট্রন বিন্যাস হতে পর্যায় সারণিতে তার অবস্থান কিভাবে নির্ণয় করা যায়?
উত্তর : পর্যায় সারণির মূল ভিত্তি হচ্ছে মৌলের ইলেকট্রন বিন্যাস। মৌলের ইলেকট্রন বিন্যাস হতে পর্যায় সারণিতে তার অবস্থান নির্ণয়ের নিয়গুলো হলোঃ
গ্রুপ নির্ণয়ের নিয়মঃ কোন প্রতিনিধিত্ব মূলক মৌলের সর্বশেষ স্তরে যতটি ইলেকট্রন বিদ্যমান, সেই মৌলের অবস্থান তত নম্বর শ্রেণিতে। সর্বশেষ স্তরে অষ্টক পূর্ণ হলে শূন্য গ্রুপের সদস্য হবে। পর্যায় নির্ণয়ের নিয়ম ও একটি মৌলের পরমাণুতে ইলেকট্রনসমূহ যত সংখ্যক কক্ষপথ দখল করে, তার অবস্থান তত নম্বর পর্যায়ে হয়। উদাহরণঃ K(19) এর ইলেকট্রন বিন্যাস- 1s2 2s2 2p6 3s2 3p6 4s1
অর্থাৎ পটাসিয়ামের পারমাণবিক সংখ্যা 19। এর ইলেকট্রন বিন্যাস 2, 8, 8, 1।
সুতরাং পটাসিয়ামের পরমাণুতে ইকেট্রনসমূহ চারটি স্তরে বিস্তৃত।
অতএব পটাসিয়ামের অবস্থান চতুর্থ পর্যায়ে।
প্রশ্ন ॥ ১৬ ॥ আয়নিকরণ শক্তি কাকে বলে?
উত্তর : গ্যাসীয় অবস্থায় কোন মৌলের 1.0 মোল বিচ্ছিন্ন পরমাণুর । প্রতিটির সর্ববহিঃস্থ স্তর থেকে অসীম দূরত্বে একটি করে মোট 1.0 মোল ইলেকট্রন অপসারণ করে পরমাণুকে ধনাত্মক আয়নে পরিণত করতে যে শক্তির প্রয়োজন হয় তাকে আয়নীকরণ শক্তি বলে। অর্থাৎ কোন মৌলের সর্ব বহিঃস্থ শক্তিস্তর থেকে ইলেকট্রন সরিয়ে ধনাত্মক আয়নেপরিণত করতে যে পরিমাণ শক্তি প্রয়োজন হয় তাকে ঐ মৌলের আয়ণিকরণ শক্তি বলে। আয়নিকরণ শক্তি হল মৌলের একটি গুরুত্বপূর্ণ পর্যায়বৃত্তিক ধর্ম।
প্রশ্ন ॥ ১৭ ॥ পরমাণুর কেন্দ্রে সমধর্মী চার্জ বিশিষ্ট প্রোটন পরস্পরকে বিকর্ষণ করে না কেন?
উত্তর : পরমাণুর কেন্দ্র ধনাত্মক চার্জ বিশিষ্ট একে নিউক্লিয়াস বলা হয়। বিদ্যুতের চার্জের ধর্ম হতে আমরা জানি যে, সমধর্মী চার্জ পরস্পরকে বিকর্ষণ করে। এ ধর্ম মতে ধনাত্মক আধান বিশিষ্ট নিউক্লিয়াসের প্রোটন সমূহ পরস্পর কে বিকর্ষণ করার কথা কিন্তু তা হয় না। কারণ প্রোটন সমূহকে পরস্পর হতে দূরে যেতে বাধা প্রদান করে নিউট্রন। নিউক্লিাসে এ নিউট্রন থাকার দরূন প্রোটন সমূহ পরস্পকে বিকর্ষণ করে।
এসএসসি বাংলা দ্বিতীয় পত্র বহুনির্বাচনি প্রশ্নোত্তর পেতে এখানে ক্লিক করুন
প্রশ্ন ॥ ১৮ ॥ মুদ্রা ধাতু বলতে কী বুঝ?
উত্তর : মুদ্রা ধাতু : পর্যায় সারণিতে গ্রুপ-11-তে অবস্থিত মৌল-তামা। (Cu), রুপা (Ag) ও সোনা (Au) এদের ধাতব বৈশিষ্ট্যসহ উজ্জ্বলতা বিদ্যমান। ঐতিহাসিকভাবে এসব ধাতু দ্বারা মুদ্রা তৈরি করে তাদেরকে ক্রয়-বিক্রয় ও অন্যান্য প্রয়োজনে বিনিময়ের মাধ্যম হিসেবে ব্যবহার করা হয়। এদেরকে মুদ্রা ধাতু (coinage metals) বলা হয়। প্রকৃতপক্ষে এরা অবস্থান্তর মৌল।
প্রশ্ন ॥ ১৯ ॥ হ্যালোজেন বলতে কী বুঝ?
উত্তর : হ্যালোজেন : গ্রুপ-17 তে অবস্থিত মৌল F, CI, Br, I ও At এই। 5টি মৌলকে একত্রে হ্যালোজেন (halogen) বলে। হ্যালোজেন শব্দের অর্থ লবণ গঠনকারী (salt maker)। এরা সর্ববহিঃস্থ শক্তিস্তরে একটি ইলেকট্রন গ্রহণের মাধ্যমে হ্যালাইড আয়ন তৈরি করে। হ্যালোজেনসমূহের মূল উৎস সামুদ্রিক লবণ। এরা নিজে নিজেই ইলেকট্রন ভাগাভাগির(electron sharing)মাধ্যমে দ্বি-মৌল অণু তৈরি করে।
প্রশ্ন ॥ ২০ ॥ নিস্ক্রিয় গ্যাস বলতে কী বুঝ?
উত্তর : নিস্ক্রিয় গ্যাস : পর্যায় সারণিতে গ্রুপ-18-তে অবস্থিত মৌলসমূহকে নিষ্ক্রিয় মৌল বলে। কারণ এদের সর্ববহিঃস্থ শক্তির প্রয়োজনীয় সংখ্যক ইলেকট্রন দ্বারা পূর্ণ থাকায় এরা ইলেকট্রন আদানপ্রদান বা শেয়ারের মাধ্যমে সাধারণত যৌগ গঠন করে না।
প্রশ্ন ॥ ২১ ॥ অপধাতু বা উপধাতু বলতে কী বুঝ?
উত্তর : অপধাতু বা উপধাতু : যে মৌলের ধাতু ও অধাতু উভয় ধরনের বৈশিষ্ট্য রয়েছে তাকে অপধাতু বা উপধাতু বলা হয়। যেমন : বোরন (B), সিলিকন (Si), আর্সেনিক (As), টেলুরিয়াম (Te) ইত্যাদি।
গুরুত্বপূর্ণ বহুনির্বাচনি প্রশ্ন ও উত্তর
১. কোন মৌলটির ধাতব বৈশিষ্ট্য সর্বাধিক?
ক. Al খ. Si
গ. P ঘ. Mg
উত্তর: ঘ. Mg
২. সালফারের সাথে নিচের কোন মৌলের ধর্মের মিল আছে?
ক. Mg খ. O
গ. Si ঘ. C
উত্তর: খ. O
পদার্থ বিজ্ঞান প্রথম অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
৩. 16নং গ্রুপের মৌলের অক্সাইড কোনটি?
ক. Al2O3 খ. CO2
গ. Cl2O7 ঘ. SO2
উত্তর: ঘ. SO2
৪. 1s22s22p63s23p63d5 ইলেকট্রন বিন্যাস কোন আয়নের?
ক. Fe2+ খ. Fe3+
গ. CO3+ ঘ. Cr3+
উত্তর: খ. Fe3+
৫. পর্যায় সারণিতে মুদ্রা ধাতুর অবস্থান কোন গ্রুপে?
ক. 2 খ. 8
গ. 10 ঘ. 11
উত্তর: ঘ. 11
৬. কোনটি নিষ্ক্রিয় ধাতু?
ক. প্লাটিনাম খ. কপার
গ. অ্যালুমিনিয়াম ঘ. ক্রোমিয়াম
উত্তর: ক. প্লাটিনাম
৭. নিচের কোনটির পারমাণবিক ব্যাসার্ধ বেশি?
ক. Mg খ. Ca
গ. P ঘ. Zn
উত্তর: খ. Ca
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
৮. পর্যায় সারণির ৫ম পর্যায়ে মৌলের সংখ্যা কতটি?
ক. ৪ খ. 16
গ. 18 ঘ. 32
উত্তর: গ. 18
৯. পর্যায় সারণিতে কতটি মৌলকে প্রাথমিক মৌল বলা হয়?
ক. 98 খ. 84
গ. 33 ঘ. 14
উত্তর: খ. 84
১০. M – 1s2 2s2 2p6 3s2 3p6 3d1 4s2 মৌলটির অবস্থান কোন গ্রুপে?
ক. গ্রুপ-2 খ. গ্রুপ-3
গ. গ্রুপ-4 ঘ. গ্রুপ-9
উত্তর: খ. গ্রুপ-3
১১. কোনটির আয়নিকরণ শক্তি কম?
ক. Li খ. K
গ. Na ঘ. Rb
উত্তর: ঘ. Rb
১২. Sc এর ৩য় শেলে ইলেকট্রন কতটি?
ক. 1 খ. 2
গ. 6 ঘ. 9
উত্তর: ঘ. 9
১৩. মুদ্রা ধাতু কোনটি?
ক. পারদ খ. লোহা
গ. তামা ঘ. দস্তা
উত্তর: গ. তামা
১৪. আয়রনের M শেলে কতটি ইলেকট্রন বিদ্যমান?
ক. 8 খ. 10
গ. 14 ঘ. 18
উত্তর: গ. 14
১৫. ল্যাভয়সিয়ে কতটি মৌল নিয়ে ছক তৈরি করেছিলেন?
ক. 33 খ. 63
গ. 67 ঘ. 92
উত্তর: ক. 33
১৬. মেন্ডেলিফ কত সালে পর্যায় সূত্র প্রদান করেন?
ক. 1789 খ. 1869
গ. 1894 ঘ. 1896
উত্তর: খ. 1869
ICT বিষয়ে সাজেশন পেতে এখানে ক্লিক করুন
১৭. মেন্ডেলিফ কতটি মৌল নিয়ে আধুনিক পর্যায় সারণি প্রবর্তন করেন?
ক. 63 খ. 67
গ. 84 ঘ. 98
উত্তর: খ. 67
১৮. IUPAC কর্তৃক স্বীকৃত মৌলের সংখ্যা কতটি?
ক. 98 খ. 112
গ. 114 ঘ. 118
উত্তর: ঘ. 118
১৯. পর্যায় সারণিতে ৬ষ্ঠ পর্যায়ে কতটি মৌল অবস্থিত?
ক. 2 খ. 8
গ. 18 ঘ. 32
উত্তর: ঘ. 32
২০. পর্যায় সারণিতে কতটি গ্রুপ আছে?
ক. 7 খ. 9
গ. 18 ঘ. 20
উত্তর: গ. 18
২১. কোন পারমাণবিক সংখ্যাবিশিষ্ট মৌলটি এক পরমাণুক?
ক. ৪ খ. 16
গ. 17 ঘ. 54
উত্তর: ঘ. 54
২২. অষ্টক তত্ত্বের প্রবর্তক কে?
ক. ডোবেরাইনার খ. জন নিউল্যান্ড
গ. ল্যাভয়সিয়ে ঘ. ম্যান্ডেলিফ
উত্তর: খ. জন নিউল্যান্ড
২৩. কোন বিজ্ঞানী পারমাণবিক সংখ্যার ধারণা দেন?
ক. ডিমিট্রি মেন্ডেলিফ খ. নীলস্ বোর
গ. হেনরি মোসলে ঘ. রাদারফোর্ড
উত্তর: গ. হেনরি মোসলে
২৪. অভিজাত ধাতু কোনটি?
ক. Fe খ. Zn
গ. Al ঘ. Au
উত্তর: ঘ. Au
জীববিজ্ঞান চতুর্থ অধ্যায় সাজেশন
২৫. ‘ডোবেরাইনারের ত্রয়ী’ হিসেবে পরিচিত মৌলগুলোর যোজ্যতা ইলেকট্রন সংখ্যা কত?
ক. 1 খ. 2
গ. 3 ঘ. 4
উত্তর: ক. 1
২৬. আধুনিক পর্যায় সূত্র আবিষ্কৃত হয় কত সালে?
ক. 1789 খ. 1813
গ. 1869 ঘ. 1913
উত্তর: গ. 1869
২৭. পর্যায় সারণির মূল ভিত্তিক?
ক. ইলেকট্রন বিন্যাস খ. পারমাণবিক ভর
গ. ইলেকট্রন সংখ্যা ঘ. নিউট্রন সংখ্যা
উত্তর: ক. ইলেকট্রন বিন্যাস
২৮. আয়রনের পারমাণবিক সংখ্যা কত?
ক. 56 খ. 46
গ. 36 ঘ. 26
উত্তর: ঘ. 26
২৯. চতুর্থ পর্যায়ের মৌল কোনটি?
ক. Mg খ. CI
গ. Cr ঘ. Sr
উত্তর: গ. Cr
৩০. সিলভারের পারমাণবিক সংখ্যা কত?
ক. 44 খ. 45
গ. 46. ঘ. 47
উত্তর: ঘ. 47
৩১. একটি মৌলের ইলেকট্রন বিন্যাস হচ্ছে 2, ৪, ৪, 1 পর্যায় সারণিতে মৌলটির অবস্থান হলো—
ক. ৪র্থ পর্যায় এবং প্রথম গ্রুপ
খ. ৩য় পর্যায় এবং প্রথম গ্রুপ
গ. ৬ষ্ঠ পর্যায় এবং দ্বিতীয় গ্রুপ
ঘ. ৪র্থ পর্যায় এবং তৃতীয় গ্রুপ
উত্তর: ক. ৪র্থ পর্যায় এবং প্রথম গ্রুপ
৩২. পর্যায় সারণিতে, V মৌলটির অবস্থান কোথায়?
ক. পর্যায় 3, গ্রুপ 12 খ. পর্যায় 4, গ্রুপ 5
গ. পর্যায় 4, গ্রুপ 15 ঘ. পর্যায় 4, গ্রুপ 2
উত্তর: খ. পর্যায় 4, গ্রুপ 5
৩৩. ‘A’ মৌলটির পারমাণবিক সংখ্যা 26, পর্যায় সারণিতে মৌলটির অবস্থান কোথায়?
ক. চতুর্থ পর্যায়, গ্রুপ-৪ খ. চতুর্থ পর্যায়, গ্রুপ-9
গ. পঞ্চম পর্যায়, গ্রুপ-7 ঘ. পঞ্চম পর্যায়, গ্রুপ-10
উত্তর: ক. চতুর্থ পর্যায়, গ্রুপ-৪
পদার্থ বিজ্ঞান দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
৩৪. পর্যায় সারণিতে সালফারের অবস্থান–
ক. ৩য় পর্যায় ও গ্রুপ 16
খ. ৪র্থ পর্যায় ও গ্রুপ 16
গ. ৫ম পর্যায় ও গ্রুপ 15
ঘ. ৭ম পর্যায় ও গ্রুপ 15
উত্তর: ক. ৩য় পর্যায় ও গ্রুপ 16
৩৫. পর্যায় সারণিতে ফসফরাসের অবস্থান কোন গ্রুপে?
ক. গ্রুপ-17 খ. গ্রুপ-15
গ. গ্রুপ-14 ঘ. গ্রুপ-13
উত্তর: খ. গ্রুপ-15
৩৬. পর্যায় সারণিতে Al এর অবস্থান কোন গ্রুপে?
ক. 11 খ. 13
গ. 15 ঘ. 17
উত্তর: খ. 13
৩৭. 1s22s22p63s23p63d54s1 মৌলটি পর্যায় সারণির কোন গ্রুপে অবস্থিত?
ক. 14 খ. 6
গ. 5 ঘ. 1
উত্তর: খ. 6
৩৮. এটি পর্যায় সারণির একটি পর্যায়ের খন্ডিত অংশ।

A মৌলটি সারণির কোন পর্যায়ে অবস্থান করছে?
ক. 6 খ. 4
গ. 3 ঘ. 2
উত্তর: খ. 4
৩৯. Ca এর অবস্থান পর্যায় সারণির কোন পর্যায়ে ও কোন গ্রুপে?
ক. 2, 2 খ. 4, 2
গ. 2, 4 ঘ. 2, 3
উত্তর: খ. 4, 2
৪০. X-মৌলটির ইলেকট্রন বিন্যাস-
1s22s22p63s23p63d54s2 মৌলটি পর্যায় সারণির কোন গ্রুপে অবস্থিত?
ক. গ্রুপ-2 খ. গ্রুপ-7
গ. গ্রুপ-13 ঘ. গ্রুপ-15
উত্তর: খ. গ্রুপ-7
রসায়ন তৃতীয় অধ্যায় সাজেশন
৪১. মনে করো একটি মৌলের সুস্থিত আয়ন A2+ এর ইলেকট্রন বিন্যাস- 1s2 2s2 2p6 3s2 3p6 মৌলের গ্রুপ কোনটি?
ক. 2 খ. 6
গ. 8 ঘ. 10
উত্তর: ক. 2
৪২. ম্যাগনেসিয়াম পর্যায় সারণির কোন পর্যায়ে অবস্থিত?
ক. ১ম খ. ২য়
গ. ৩য় ঘ. ৪র্থ
উত্তর: গ. ৩য়
৪৩. অপেক্ষাকৃত ধাতব ধর্ম বেশি কোন মৌলটির?
ক. Li খ. Na
গ. K ঘ. Mg
উত্তর: ক. Li
৪৪. কোন মৌলটির পারমাণবিক ব্যাসার্ধ সবচেয়ে কম?
ক. P খ. S
গ. Mg ঘ. Na
উত্তর: খ. S
৪৫. কোন মৌলটির ধাতব ধর্ম বেশি?
ক. Si খ. Na
গ. Al ঘ. Mg
উত্তর: খ. Na
এসএসসি সকল বিষয় সাজেশন পেতে এখানে ক্লিক করুন
৪৬. সক্রিয়তার সঠিক ম কোনটি?
ক. K> Na > Al খ. Zn > Al > Ca
গ. Cu > Fe> Pb ঘ. Mg >Na > Al
উত্তর: ক. K> Na > Al
৪৭. কোন মৌলটির পারমাণবিক ব্যাসার্ধ বেশি?
ক. K খ. Si
গ. Na ঘ. Al
উত্তর: ক. K
৪৮. কোনটির গলনাংক সবচেয়ে বেশি?
ক. অ্যালুমিনিয়াম খ. ম্যাগনেসিয়াম
খ. পটাসিয়াম ঘ. সোডিয়াম
উত্তর: ক. অ্যালুমিনিয়াম
৪৯. নিচের কোনটির আয়নিকরণ শক্তি বেশি?
ক. Na খ. Mg
গ. Al ঘ. Si
উত্তর: ঘ. Si
৫০. ক্ষার ধাতুসমূহের সক্রিয়তার ক্রম কোনটি?
ক. Cs>Rb>K>Na খ. Rb>K>Na>Cs
গ. Cs>K>Na>Rb ঘ. Na>K>Cs>Rb
উত্তর: ক. Cs>Rb>K>Na
৫১. কোনটির আকার সবচেয়ে বড়?
ক. Na খ. Na+
গ. Mg2+ ঘ. Al3+
উত্তর: ক. Na
৫২. কোনটির পারমাণবিক ব্যাসার্ধ সর্বোচ্চ?
ক. Mg খ. Si
গ. Al ঘ. S
উত্তর: ক. Mg
৫৩. তড়িৎ ঋণাত্মকতা কোনটির বেশি?
ক. F খ. S
গ. O ঘ. N
উত্তর: ক. F
৫৪. তৃতীয় পর্যায়ের 16 নং শ্রেণির মৌলটির উত্তেজিত অবস্থায় যোজ্যতা শক্তি স্তরে সর্বোচ্চ কতটি বিজোড় ইলেকট্রন থাকতে পারে?
ক. 2 খ. 4
গ. 6 ঘ. 8
উত্তর: গ. 6
৫৫. নিচের কোন মৌলটি ক্ষার ধাতু?
ক. Mg খ. Rb
গ. Ca ঘ. Ra
উত্তর: খ. Rb
৫৬. নিচের কোনটি মুদ্রা ধাতু?
ক. Au খ. Hg
গ. Na ঘ. Zn
উত্তর: ক. Au
৫৭. অবস্থান্তর মৌল কোনটি?
ক. Sc খ. Ca
গ. Zn ঘ. Fe
উত্তর: ঘ. Fe
৫৮. কোনটি অবস্থান্তর মৌল?
ক. Al খ. Ni
গ. As ঘ. Lu
উত্তর: খ. Ni
৫৯. নিচের কোন মৌলটি মুদ্রা ধাতু?
ক. Ar খ. Ag
গ. Cd ঘ.Cr
উত্তর: খ. Ag
৬০. কত সালে ত্রয়ী সূত্র আবিষ্কার হয়?
ক. ১৮২৯ সালে খ. ১৮৬৪ সালে
গ. ১৮৬৯ সালে ঘ. ১৯১৩ সালে
উত্তর: ক. ১৮২৯ সালে
বাংলা দ্বিতীয় পত্র বহুনির্বাচনি প্রশ্নোত্তর পেতে এখানে ক্লিক করুন
৬১. প্রকৃতিতে প্রাপ্ত মৌলের সংখ্যা কতটি?
ক. 33 খ. 67
গ. 84 ঘ. 98
উত্তর: ঘ. 98
৬২. মারকারির প্রতীক কোনটি?
ক. Mr খ. Mg
গ. Mn ঘ. Hg
উত্তর: ঘ. Hg
৬৩. A = 1s2 2s2 2p63s23p4 ; A মৌলটি-
i. অক্সিজেনের সাথে একই গ্রুপে অবস্থান করে
ii. যে অক্সাইড তৈরি করে তা অম্লধর্মী
iii. অলিয়াম তৈরিতে ব্যবহৃত হয়
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
৬৪. 14R মৌলটির ক্ষেত্রে—
i. এর অক্সাইডটি উচ্চ গলনাঙ্ক ও স্ফুটনাঙ্কবিশিষ্ট
ii. এটি পর্যায় সারণির চতুর্থ গ্রুপের মৌল
iii. ব্রোমিনের সাথে এটি আয়নিক বন্ধন গঠন করে
নিচের কোনটি সঠিক?
ক. i খ. ii
গ. i ও iii ঘ. i, ii ও iii
উত্তর: ক. i
৬৫. পর্যায় সারণির মৌলের পর্যায়বৃত্ত ধর্ম বাম থেকে ডান দিকে হ্রাস পায়–
i. পরমাণুর আকার
ii. ধাতব বৈশিষ্ট্য
iii. ইলেকট্রন আসক্তি
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ক. i ও ii
| Mg | Al | X | P | S | Y | Ar |
৬৬. পর্যায়টিতে –
i. বাম থেকে ডানে পারমাণবিক আকার বৃদ্ধি পায়
ii. X ও Y মৌল দ্বারা গঠিত যৌগ সমযোজী
iii. Y মৌলটির আয়নিকরণ শক্তি বেশি
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: গ. ii ও iii
৬৭. অবস্থান্তর মৌলের ক্ষেত্রে প্রযোজ্য–
i. মৌলসমূহের নিজস্ব বর্ণ আছে
ii. মৌলগুলো দ্বারা গঠিত যৌগ আয়নিক
iii. পরিবর্তনশীল যোজ্যতা প্রদর্শন করে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
৬৮. একই পর্যায়ে বাম থেকে ডানদিকে গেলে–
i. আয়নিকরণ শক্তি বাড়ে
ii. তড়িৎ ঋণাত্মকতা কমে
iii. ইলেকট্রন আসক্তি বাড়ে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: খ. i ও iii
৬৯. A, B ও C মৌল তিলটির প্রোটন সংখ্যা যথাক্রমে 4, 5 এবং 14. মৌল তিনটির ক্ষেত্রে–
i. পারমাণবিক আকারের ক্রম; C>B> A
ii. আয়নিক শক্তির ক্রম : A> B >C
iii. ইলেকট্রন আসক্তির ক্রম : C > A> B
নিচের কোনটি সঠিক?
ক. i খ. ii
গ. iii ঘ. i, ii ও iii
উত্তর: গ. iii
৭০. Zn, Fe এবং Cu মৌলসমূহ–
i. সবগুলোই ধাতু
ii. যৌগ গঠন করে
iii. পরিবর্তনশীল যোজ্যতা প্রদর্শন করে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
৭১. অবস্থান্তর মৌলসমুহ–
i. পর্যায় সারণীর 17 নং গ্রুপে অবস্থিত
ii. এদের নিজস্ব বর্ণ আছে
iii. সর্ববহিঃস্থ শক্তি স্তরের ইলেকট্রন দান করে আয়নিক যৌগ গঠন করে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: গ. ii ও iii
৭২. ধাতুর ক্ষেত্রে –
i. সবচেয়ে হালকা ধাতু Li
ii. দামী ধাতু Pt
iii. বিরল মৃত্তিকা ধাতু Rh
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ক. i ও ii
৭৩. মৃৎক্ষার ধাতুর বৈশিষ্ট্য হলো—
i. এরা অনেকটা ধাতুর মতোই
ii. এদের অক্সাইডসমূহ পানিতে ক্ষারীয় দ্রবণ তৈরি করে
iii. এদের সর্ববহিঃস্থ স্তরে 2টি ইলেকট্রন থাকে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
৭৪. প্রায় একই ধর্মবিশিষ্ট মৌল হচ্ছে—
i. সোডিয়াম
ii. পটাশিয়াম
iii. ম্যাগনেসিয়াম
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
জীববিজ্ঞান চতুর্থ অধ্যায় সাজেশন
৭৫. অবস্থান্তর মৌলসমূহের বৈশিষ্ট্য–
i. আয়নিক অবস্থায় d অরবিটাল পূর্ণ থাকতে পারে
ii. পরিবর্তনশীল যোজনী প্রদর্শন করে
iii. রঙিন যৌগ গঠন করে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: গ. ii ও iii
৭৬. পর্যায় সারণির 3-10 নং গ্রুপের মৌলগুলো–
i. পরিবর্তনশীল যোজ্যতা প্রদর্শন করে
ii. রজিন যৌগ গঠন করে
iii. সকলেই ধাতু নিচের
কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
৭৭. মুদ্রা ধাতু–
i. গ্রুপ-II তে অবস্থিত
ii. পরিবর্তনশীল যোজনী প্রদর্শন করে
iii. নিজস্ব বর্ণ প্রদর্শন করে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: গ. ii ও iii
৭৮. নিষ্ক্রিয় গ্যাসগুলো–
i. পর্যায় সারণীর গ্রুপ-১৮ তে অবস্থিত
ii. এদের সর্ববহিঃস্থ স্তরে ৮টি ইলেকট্রন থাকে
iii. যৌগ গঠনে আগ্রহ প্রদর্শন করে না
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
৭৯. নিষ্ক্রিয় গ্যাস পযায় সারণির–
i. সর্বডানে অবস্থিত
ii. শূন্য গ্রুপের মৌল
iii. তৃতীয় পর্যায়ের মৌল
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ক. i ও ii
উদ্দীপক অনুসারে ৮০ ও ৮১ নং প্রশ্নের উত্তর দাও:
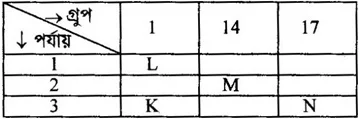
[ এখানে K, L, M, N প্রতীক অর্থে ব্যবহৃত ]
৮০. উদ্দীপকে –
i. K এর পারমাণবিক আকার N অপেক্ষা বেশি
ii. L এর আয়নিকরণ শক্তি K অপেক্ষা কম
iii. N এর স্ফুটনাঙ্ক K অপেক্ষা কম
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: খ. i ও iii
রসায়ন তৃতীয় অধ্যায় সাজেশন
৮১. কোন যৌগটি তেলে দ্রবীভূত?
ক. MN4 খ. KN
গ. KL ঘ. LN
উত্তর: ক. MN4
৮২ ও ৮৩ নং প্রশ্নের উত্তর দাও :
| 13Al | 14Si | 15P | 16S |
৮২. দৃশ্যকল্পের কোন মৌলের আয়নীকরণ শক্তি সবচেয়ে বেশি?
ক. S খ. Si
গ. Al ঘ. P
উত্তর: ঘ. P
৮৩. একাধিক যোজনী প্রদর্শন করে কোন কোন মৌল?
ক. P, Al খ. P, S
গ.P, Si ঘ. Al, Si
উত্তর: খ. P, S
নিচের উদ্দীপকটি পড়ে ৮৪ ও ৮৫ নং প্রশ্নের উত্তর দাও:
একটি মৌলের পরমাণুর যোজ্যতাস্তরের ইলেকট্রনীয় গঠন, 3d1 4s2।
৮৪. পর্যায় সারণিতে মৌলটির অবস্থান কোনটি সঠিক?
ক. গ্রুপ-3, পর্যায়-3 খ. গ্রুপ-3, পর্যায়-4
গ. গ্রুপ-13, পর্যায়-3 ঘ. গ্রুপ-13, পর্যায়-4
উত্তর: খ. গ্রুপ-3, পর্যায়-4
৮৫. মৌলটি অবস্থান্তর ধাতু নয়। কারণ—
i. এটির জারণ সংখ্যা +3
ii. এটির আয়নের বহিঃস্থ d-. অরবিটালের কাঠামো অপূর্ণ
iii. এটি রঙিন যৌগ গঠন করে না
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: গ. ii ও iii
ICT প্রথম অধ্যায় বহুনির্বাচনি সাজেশন পেতে এখানে ক্লিক করুন
নিচের উদ্দীপকের আলোকে ৮৬ ও ৮৭ নং প্রশ্নের উত্তর দাওঃ
47X মৌলটির ১টি পরমাণুর ভর 1.791 x 10-22g (X প্রচলিত কোন মৌল নয়)
৮৬. মৌলটি পর্যায় সারণির কোন গ্রুপে অবস্থিত?
ক. 1 খ. 2
গ. 11 ঘ. 12
উত্তর: গ. 11
৮৭. মৌলটির আপেক্ষিক পারমাণবিক ভর কত?
ক. 9.27 x 10-3 g খ. 1.66 x 10-2 g
গ. 10.6g ঘ. 107.89 g
উত্তর: ঘ. 107.89 g
আরও গুরুত্বপূর্ণ বহুনির্বাচনি প্রশ্ন ও উত্তর PDF পেতে এখানে ক্লিক করুন
গুরুত্বপূর্ণ সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন–১ : নিচের ছকটি দেখে প্রশ্নগুলোর উত্তর দাও :
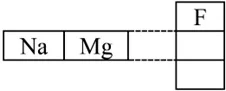
উদ্দীপকের চিত্রটি পর্যায় সারণির একটি খণ্ডিত অংশ
ক. ত্রয়ী সূত্রটি লিখ।
খ. বেরিয়ামকে মৃৎক্ষার ধাতু বলা হয় কেন- ব্যাখ্যা কর।
গ. উদ্দীপকের কোন মৌলটির আকার সবচেয়ে বড়? ব্যাখ্যা কর।
ঘ. উদ্দীপকের পর্যায় ও গ্রুপের প্রথম মৌল দুটি উচ্চমাত্রায় সক্রিয় হলেও সক্রিয়তার কারণ ভিন্ন—যুক্তি দাও।
১নং প্রশ্নের উত্তর
ক. ত্রয়ী সূত্রটি হলো— পর্যায় সারণির তিনটি মৌলকে পারমাণবিক ভর অনুসারে সাজালে প্রথম এবং তৃতীয় মৌলের ভরের গড় দ্বিতীয় মৌলের ভরের সমান হয় এবং এই তিনটি মৌলের ধর্ম একই রকম হয়।
খ. বেরিয়াম মৌলটি গ্রুপ-2 তে অবস্থিত বলে একে মৃৎক্ষার ধাতু বলা হয়। গ্রুপ-2 এ অবস্থিত বেরিলিয়াম (Be) থেকে শুরু করে রেডিয়াম (Ra) পর্যন্ত মৌলসমূহকে মৃৎক্ষার ধাতু বলা হয়। এসব মৌলের বিভিন্ন যৌগ মাটিতে পাওয়া যায় বলে এদের মৃৎক্ষার ধাতু বলা হয়। যেহেতু বেরিয়াম (Ba) মৌলটি গ্রুপ-2 এ অবস্থিত, তাই একে মৃৎক্ষার ধাতু বলা হয়।
গ. উদ্দীপকের সোডিয়াম (Na) মৌলটির আকার সবচেয়ে বড়।
আমরা জানি, পর্যায় সারণির যে কোনো পর্যায়ে যতই বামদিক থেকে ডানদিকে যাওয়া যায়, অর্থাৎ পারমাণবিক সংখ্যা যতই বাড়ে, পরমাণুর আকার ততই হ্রাস পায়। যেহেতু, Na ও Mg পর্যায় সারণির তৃতীয় পর্যায়ে অবস্থিত এবং Na এর ডানে Mg অবস্থিত অর্থাৎ Na এর পারমাণবিক সংখ্যা 11। Mg এর পারমাণবিক সংখ্যা 12, অর্থাৎ Na অপেক্ষা Mg এর পারমাণবিক সংখ্যা 1 বেশি। তাই, Na এর আকার Mg অপেক্ষা বেশি হবে।
আবার, F এর ঠিক নিচের মৌলটিও এ পর্যায়ে অবস্থিত। এই মৌলটি একই গ্রুপে অবস্থিত F এর তুলনায় বড়, কারণ পর্যায় সারণির একই গ্রুপের উপর থেকে নিচে পারমাণবিক আকার বৃদ্ধি পায়। কিন্তু এই মৌলটির তুলনায় একই পর্যায়ে সর্ববামে অবস্থিত Na আকারে বড়।।
অতএব, উদ্দীপকের Na মৌলটির আকার সবচেয়ে বড়।
ঘ. উদ্দীপকের প্রদত্ত পর্যায়টির প্রথম মৌল তৃতীয় পর্যায়ের Na ও প্রদত্ত গ্রুপটির প্রথম মৌল 17 গ্রুপের F উভয়ে উচ্চমাত্রার সক্রিয় মৌল। কিন্তু তাদের সক্রিয়তার কারণ সম্পূর্ণ ভিন্ন।
কোনো মৌলের সক্রিয়তার নিয়ামক হলো তার গলনাংক ও ফুটনাংক, ধাতব ও অধাতব বৈশিষ্ট্য, ঘনত্ব, আয়নিকরণ শক্তি, তড়িৎ ঋণাত্মকতা, ইলেকট্রন আসক্তি ইত্যাদি ধর্ম। ধাতুর ক্ষেত্রে যেসব মৌলের আয়নিকরণ শক্তি, তড়িৎ ঋণাত্মকতা ও ইলেকট্রন আসক্তি কম সে ধাতুর সক্রিয়তা বেশি। কারণ ধাতুসমূহ তড়িৎ ধনাত্মক মৌল।
অন্যদিকে, অধাতুর ক্ষেত্রে যে মৌলের এসব ধর্ম বেশি সে অধাতু অধিক সক্রিয়। পর্যায় সারণির একই পর্যায়ের বামদিক থেকে ডানদিকে পারমাণবিক সংখ্যা বৃদ্ধির সাথে এসব ধর্ম ক্রমশ বৃদ্ধি পায়। পর্যায় সারণির একই পর্যায়ের সর্ববামের মৌলগুলোর ধাতব ধর্ম বেশি। যেমন ৩য় পর্যায়ের সর্ববামে 1নং গ্রুপে সোডিয়াম রয়েছে, যা একটি সক্রিয় ধাতু এবং সর্বাডানে অবস্থিত 17 নং গ্রুপের ক্লোরিন একটি সক্রিয় অধাতু। এই গ্রুপেরই ক্লোরিনের উপরে ২য় পর্যায়ে রয়েছে ফ্লোরিন।
ফ্লোরিন ক্লোরিনের চেয়ে অধিক সক্রিয়। কারণ, কোনো একটি গ্রুপের মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে উপর থেকে নিচে উক্ত ধর্মসমূহ হ্রাস পায়। ফলে গ্রুপ -1 এর Na ধাতুর তুলনায় এর নিচের ধাতুগুলোর সক্রিয়তা কম আবার গ্রুপ 17-এর F অধাতুর তুলনায় এর নিচের অধাতুসমূহের সক্রিয়তা কম। অর্থাৎ Na ও F উভয়েই সক্রিয় কিন্তু Na ধাতু হিসেবে সক্রিয় ও F অধাতু হিসেবে সক্রিয়।
অতএব দেখা যাচ্ছে যে, উদ্দীপকের পর্যায় ও গ্রুপের প্রথম মৌল দুটি অর্থাৎ সোডিয়াম (Na) ধাতব বৈশিষ্ট্য বহনকারী সক্রিয় মৌল এবং ফ্লোরিন (F) অধাতব বৈশিষ্ট্য বহনকারী সক্রিয় মৌল। তাই বলা হয়, উদ্দীপকের পর্যায় (Na) ও গ্রুপের (F) প্রথম মৌল দুটি উচ্চমাত্রায় সক্রিয় হলেও সক্রিয়তার কারণ ভিন্ন।
প্রশ্ন-২ : নিচের ছকটি দেখে প্রশ্নগুলোর উত্তর দাও :
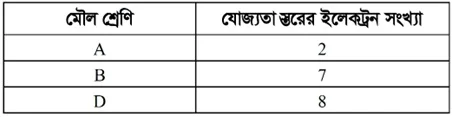
[এখানে A, B এবং D প্রতীকী অর্থে; প্রচলিত কোনো মৌলের প্রতীক নয়]
ক. মুদ্রা ধাতু কী?
খ. He-কে গ্রুপ-II এ রাখা হয়নি কেন? ব্যাখ্যা কর।
গ. B শ্রেণির মৌলের উৎস ব্যাখ্যা কর।
ঘ. A ও D শ্রেণির মৌলগুলোর রাসায়নিক ধর্মের তুলনা কর।
২নং প্রশ্নের উত্তর
ক. যেসব ধাতু উজ্জ্বল, চকচকে এবং ঐতিহাসিকভাবে মুদ্রা তৈরি, ক্রয়-বিক্রয় ও অন্যান্য প্রয়োজনে বিনিময়ের মাধ্যম হিসেবে ব্যবহৃত হয়, তাদেরকে মুদ্রা ধাতু বলা হয়।
এসএসসি তথ্য ও যোগাযোগ প্রযুক্তি বহুনির্বাচনি প্রশ্ন ও উত্তর pdf পেতে এখানে ক্লিক করুন
খ. He নিষ্ক্রিয় গ্যাস বলে একে গ্রুপ-II তে রাখা হয়নি। He-এর ইলেকট্রন বিন্যাস-1s2। ইলেকট্রন বিন্যাস অনুসারে He কে গ্রুপ-II মৌলের সাথে রাখা উচিত। গ্রুপ-II এর প্রত্যেকটি মৌলে সর্বশেষ শক্তিস্তরে যে দুটি করে ইলেকট্রন আছে (ns2) এবং তা অপূর্ণ, কিন্তু He এর সর্বশেষ ১ম শক্তিস্তর দুটি ইলেকট্রন (1s2) দ্বারা পূর্ণ অর্থাৎ He এর যোজনী শূন্য এবং এটি একটি নিষ্ক্রিয় মৌল। অন্যদিকে, গ্রুপ-II এর মৌলগুলো মৃৎক্ষার ধাতু এবং তাদের প্রত্যেকের যোজনী 2। অর্থাৎ গ্রুপ-II হলো মৃৎক্ষার ধাতুসমূহের শ্রেণি আর He হলো নিষ্ক্রিয় গ্যাস। এজন্যই He কে গ্রুপ-II তে রাখা হয়নি।
গ. B-শ্রেণির মৌলগুলোর মূল উৎস হলো সামুদ্রিক লবণ।
ফ্লোরিন (F), ক্লোরিন (Cl), ব্রোমিন (Br), আয়োডিন (I) ও অ্যাস্টাটিন (At) গ্রুপ 17 এর এই পাঁচটি মৌলকে একত্রে হ্যালোজেন বলা হয়। ফ্লোরিনের প্রধান উৎস হলো খনিজ লবণ। যেমন: ফ্লোরস্পার (CaF2), ক্রায়োলাইট (Na3AlF6), ফ্লোরঅ্যাপাটাইট [3Ca3(PO4)2.CaF2], দাঁতের এনামেল, ঝিনুকের খোলস ইত্যাদি।
ক্লোরিনের (Cl2) প্রধান উৎস হলো সমুদ্রের পানি। সমুদ্রের পানিতে প্রায় 2.56% NaCl আছে। এছাড়া রক সল্ট (NaCl), সিলভাইন (KCl), কার্নালাইট (KCI. MgCl2. 6H2O) ইত্যাদি খনিজ লবণেও উল্লেখযোগ্য পরিমাণ ক্লোরিন পাওয়া যায়। ব্রোমিন (Br2) এর উৎস হলো সমুদ্রের পানি। এ পানিতে Br2, ম্যাগনেসিয়াম লবণ হিসেবে দ্রবীভূত অবস্থায় থাকে। আয়োডিনের (I) প্রধান উৎস হচ্ছে সামুদ্রিক শৈবাল। সমুদ্র শৈবালের ভস্মে Nal লবণরূপে প্রায় 0.5% আয়োডিন পাওয়া যায়।
এছাড়া খনিজ লবণ চিলি সল্ট পিটার (NaNO3.NaIO3) নামক আকরিকে প্রায় 0.2% আয়োডিন পাওয়া যায়। সমুদ্রের পানিতে সামান্য পরিমাণে অ্যাস্টাটিনের সোডিয়াম লবণ পাওয়া যায়।
ঘ. A শ্রেণির মৌলের যোজ্যতা স্তরের ইলেকট্রন সংখ্যা 2। তাই এরা মৃৎক্ষার ধাতু। D শ্রেণির মৌলের যোজ্যতা স্তরের ইলেকট্রন সংখ্যা ৪। তাই এরা নিষ্ক্রিয় গ্যাস। সুতরাং A ও D শ্রেণির মৌলগুলোর রাসায়নিক ধর্ম ভিন্ন রকম।
A শ্রেণির মৌল পর্যায় সারণির গ্রুপ 2-এ অবস্থিত। এদের অক্সাইডসমূহ পানিতে ক্ষারীয় দ্রবণ তৈরি করে। এদের সর্ববহিঃস্থ শক্তিস্তরের ২টি ইলেকট্রন অধাতুকে প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে। B শ্রেণির মৌল পর্যায় সারণির গ্রুপ 18-এ অবস্থিত। এদের সর্ববহিঃস্থ শক্তিস্তর প্রয়োজনীয় সংখ্যক ইলেকট্রন দ্বারা পূর্ণ থাকায় এরা ইলেকট্রন আদান-প্রদান বা শেয়ারের মাধ্যমে যৌগ গঠনে সাধারণত আগ্রহ প্রদর্শন করে না। অর্থাৎ বন্ধন গঠনে বা রাসায়নিক বিক্রিয়ার প্রতি B শ্রেণির মৌল নিষ্ক্রিয় থাকে।
সুতরাং A ও D শ্রেণির মৌলগুলোর রাসায়নিক ধর্ম আলাদা।
প্রশ্ন –৩ : পর্যায় সারণির একটি পর্যায়ের খণ্ডিত অংশ দেয়া হলো:
| 15A | B | C |
(এখানে A, B, C প্রতীকী অর্থে, প্রচলিত কোনো মৌলের প্রতীক নয়)
ক. স্ফুটনাংক কাকে বলে?
খ. উর্ধ্বপাতন বলতে কী বুঝ?
গ. ইলেকট্রন বিন্যাস হতে ‘A’ মৌলটির পর্যায় সারণিতে। অবস্থান নির্ণয় কর।
ঘ. উদ্দীপকে A, B, C মৌল তিনটির পারমাণবিক আকারের তুলনা কর।
৩নং প্রশ্নের উত্তর
ক. স্বাভাবিক চাপে (1 atm) যে তাপমাত্রায় কোনো তরল পদার্থ গ্যাসীয় অবস্থা প্রাপ্ত হয় সেই তাপমাত্রাকে সেই পদার্থের স্ফুটনাঙ্ক বলে।
খ. যে প্রক্রিয়ায় কঠিন পদার্থকে তাপ দিলে তা সরাসরি গ্যাসে পরিণত হয় এবং ঠাণ্ডা করলে সরাসরি কঠিনে রূপান্তরিত হয়, সেই প্রক্রিয়াকে উর্ধ্বপাতন বলে। এমন কিছু পদার্থ আছে যারা কঠিন থেকে সরাসরি গ্যাসীয় অবস্থা প্রাপ্ত হয় এবং শীতলীকরণে গ্যাসীয় অবস্থা থেকে কঠিনে রূপান্তরিত হয়। এ সকল পদার্থ উর্ধ্বপাতন প্রক্রিয়ায় পৃথকীকৃত হয়।
গ. উদ্দীপকে উল্লিখিত A হলো ‘15’ পারমাণবিক সংখ্যাবিশিষ্ট মৌল যার নাম ফসফরাস। ফসফরাস মৌলটির ইলেকট্রন বিন্যাস নিম্নরূপ:
P(15) →1s2 2s22p6 3s23p3
পর্যায়ে সারণিতে কোনো মৌলের অবস্থান তার ইলেকট্রন বিন্যাস থেকে নির্ণয় করা যায়। কোনো মৌলের যতটি শক্তিস্তরে ইলেকট্রন বিন্যস্ত থাকে, শক্তিস্তরের সে সংখ্যাই হলো ঐ মৌলের পর্যায় সংখ্যা।
উদ্দীপকের মৌলটির (P) তিনটি শক্তিস্তরে ইলেকট্রন বিন্যস্ত। সুতরাং, তাদের পর্যায় সংখ্যা হবে 3। আবার, সর্ববহিঃস্থ শক্তিস্তরে অবস্থিত ইলেকট্রন সংখ্যাই কোনো নির্দিষ্ট পর্যায়ে উক্ত মৌলের গ্রুপ সংখ্যা নির্দেশ করে। উদ্দীপকের মৌলটির (P) সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন সংখ্যা 5, সুতরাং, মৌলটি গ্রুপ-5 এ স্থান পায়।
পরিশেষে বলা যায় যে, উদ্দীপকের A মৌলটি তথা ফসফরাসের অবস্থান পর্যায় সারণির তৃতীয় পর্যায়ের পঞ্চম গ্রুপে।
ঘ. উদ্দীপকে উল্লেখিত A, B ও C মৌলত্রয় যথাক্রমে 15, 16 ও 17 পারমাণবিক সংখ্যাবিশিষ্ট মৌল ফসফরাস P, সালফার S এবং ক্লোরিন Cl।
উদ্দীপকের মৌল তিনটির মধ্যে সর্বাডানে অবস্থিত ক্লোরিনের (Cl) পরমাণু সবচেয়ে ক্ষুদ্র। প্রদত্ত মৌলসমূহ সবাই তৃতীয় পর্যায়ের সদস্য। পর্যায়বৃত্তিক ধর্মানুসারে, একই পর্যায়ে বাম থেকে ডানে যাওয়া মানে হলো সর্ববহিঃস্থ স্তরে একটি করে নতুন ইলেকট্রন যোগ হওয়া। কিন্তু, শেল বা শক্তিস্তর সংখ্যা অপরিবর্তিত থাকে। পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে নিউক্লিয়াসের প্রোটন সংখ্যা বৃদ্ধি পায়। এতে নিউক্লিয়াসের আকর্ষণ ক্ষমতা বৃদ্ধি পায়। ফলে, ধনাত্মক নিউক্লিয়াসের সাথে ঋণাত্মক ইলেকট্রনের আকর্ষণ জোরদার হয়। এ আকর্ষণের কারণে ক্লোরিনের (Cl) পরমাণুর আকার পূর্ববর্তী সদস্যদের তুলনায় সংকুচিত হয়।
সুতরাং, ক্লোরিনের পরমাণুর আকার একই পর্যায়ের উদ্দীপক প্রদত্ত অন্যান্য পরমাণুসমূহ থেকে ক্ষুদ্র। উদ্দীপকের A, B, C অর্থাৎ, P, S ও Cl মৌল তিনটির পারমাণবিক আকারের তুলনা করে নিম্নরূপ ক্রম পাওয়া যায়: P>S > Cl ।
প্রশ্ন –৪ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
XCO3 + 2HCl → XCl2 + Y + H2O;
এখানে X একটি মৌল কিন্তু Y একটি যৌগিক পদার্থ।
ক. কার্বনেট লবণ HCl এর সাথে বিক্রিয়া করে কোন গ্যাস তৈরি করে?
খ. অবস্থান্তর মৌল বলতে কী বুঝ?
গ. উৎপাদের প্রথম যৌগের অধাতব মৌলের গ্রুপের উপর থেকে ৩টি মৌলের পানির সাথে ক্রিয়াশীলতার ক্রম
ব্যাখ্যা কর।
ঘ. উৎপাদের Y যৌগটির শনাক্তকরণ পরীক্ষা সমীকরণসহ বিশ্লেষণ কর।
৪নং প্রশ্নের উত্তর
ক. কার্বনেট লবণ HCl এর সাথে বিক্রিয়া করে কার্বন ডাইঅক্সাইড গ্যাস তৈরি করে।
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
খ. পর্যায় সারণিতে গ্রুপ-3 থেকে গ্রুপ-11 পর্যন্ত গ্রুপে অবস্থিত মৌলসমূহকে অবস্থান্তর মৌল বলে। অবস্থান্তর মৌলসমূহের নিজস্ব বর্ণ রয়েছে। এরা ধাতব পদার্থ হিসেবে প্রচুর ব্যবহৃত হয়। সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন প্রদান করে আয়নিক যৌগ তৈরি করে।
গ. উৎপাদের প্রথম যৌগের অধাতব মৌলটি ক্লোরিন। এটি পর্যায় সারণির গ্রুপ-17 এর সদস্য। এই গ্রুপে উপর থেকে 3টি মৌল হচ্ছে ফ্লোরিন, ক্লোরিন ও ব্রোমিন। পানির সাথে এদের সক্রিয়তার ক্রম:
ফ্লোরিন > ক্লোরিন > ব্রোমিন।
ফ্লোরিন পানির সাথে প্রচণ্ডভাবে বিক্রিয়া করে হাইড্রোজেন ফ্লোরাইড ও অক্সিজেন উৎপন্ন করে।
2H2O + 2F2 = 4HF + O2
ক্লোরিন পানিতে দ্রবীভূত হয়ে নিম্নোক্ত উভমুখী বিক্রিয়াটি করে।
Cl2 + H2O = HOCI + HCI
দীর্ঘ সময় রেখে দিলে নিম্নোক্ত বিক্রিয়া ঘটে—
2HOCl = 2HCl + O2
অর্থাৎ সর্বমোট বিক্রিয়া হচ্ছে- 2Cl2 + 2H2O = 4HCl + O2
কিন্তু ব্রোমিন পানিতে দ্রবীভূত হয়ে নিম্নোক্ত উভমুখী বিক্রিয়া করে, যা আর অগ্রসর হয় না।
H2O + Br2 = HBr + HOBr
ঘ. উৎপাদের Y যৌগটি কার্বন ডাইঅক্সাইড গ্যাস। এটির শনাক্তকরণ পরীক্ষা চুনের পানি বা Ca(OH)2 দ্বারা করা হয়।
একটি টেস্ট টিউবে (পরীক্ষা নলে) কিছু চুনের পানি নিয়ে তাতে CO2 গ্যাস চালনা করলে প্রথমে চুনের পনি ঘোলা হয়। কারণ, কার্বন ডাইঅক্সাইড চুনের পানির সাথে বিক্রিয়া করে অদ্রবণীয় ক্যালসিয়াম কার্বনেট তৈরি করে।
CO2 + Ca(OH)2 → CaCO3 + H2O
এরপর টেস্ট টিউবে আরো CO2 গ্যাস চালনা করলে কিছুক্ষণ পর টেস্ট টিউবটির দ্রবণ আবার পরিষ্কার বা স্বচ্ছ হয়। কারণ তখন ক্যালসিয়াম কার্বনেট দ্রবণীয় বাই কার্বনেটে পরিণত হয়।
CaCO3 + H2O + CO2 → Ca (HCO3)2
প্রশ্ন–৫ নিচের পর্যায় সারণির ছকটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
ক. ক্ষার ধাতু কী?
খ. একটি মৌল A এর ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s2 3p6 3d3 4s2; পর্যায় সারণিতে মৌলটির অবস্থান কোথায়?
গ. উদ্দীপকের ৩য় পর্যায়ে অবস্থিত গ্রুপ-1 ও গ্রুপ-17 এর দুটি মৌলের মধ্যে কী ধরনের বন্ধনের মাধ্যমে যৌগ গঠিত হতে পারে ইলেকট্রন বিন্যাসের সাহায্যে ব্যাখ্যা কর।
ঘ. “একই গ্রুপে অবস্থিত ধাতুসমূহের রাসায়নিক ধর্ম একই রকম।” গ্রুপ-1 এর যে কোনো দুটি ধাতুর কার্বনেটের সাথে এসিডের বিক্রিয়ার সাহায্যে উক্তিটির সত্যতা প্রমাণ কর।
৫নং প্রশ্নের উত্তর
ক. ক্ষার ধাতু হলো পর্যায় সারণির গ্রুপ-1 এ অবস্থিত মৌলসমূহ।
খ. এখানে A মৌলটির সর্ববহিস্থ শক্তিস্তর হলো 4। অতএব এটি চতুর্থ পর্যায়ের মৌল। আবার মৌলটিতে d অরবিটালে ইলেকট্রন প্রবেশ করে (3d3)। আমরা জানি, পর্যায় 4 থেকে 7 পর্যন্ত যে সকল মৌলের ইলেকট্রন d উপস্তরে প্রবেশ করে তাদের ক্ষেত্রে d উপস্তরে প্রবেশকৃত ইলেকট্রন এবং সর্বশেষ কক্ষপথের ইলেকট্রন সংখ্যার সমষ্টি তার গ্রুপ নির্দেশ করে। তাই A মৌলের গ্রুপ হলো 3 + 2 = 5 ।
সুতরাং মৌলটির অবস্থান হলো চতুর্থ পর্যায়ের গ্রুপ-5।
গ. উদ্দীপকের ৩য় পর্যায়ের গ্রুপ 1 ও গ্রুপ 17 এর মৌলদ্বয় যথাক্রমে Na ও Cl এদের পারমাণবিক সংখ্যা ও ইলেকট্রন বিন্যাস নিম্নরূপ :
11Na → 1s22s22p63s1
17Cl → 1s2 2s2 2p6 3s2 3p5
ধাতব Na পরমাণুটি একটি ইলেকট্রন দান করে স্থিতিশীল ইলেকট্রন বিন্যাস অর্জন করে এবং Na+ আয়নে পরিণত হয়। অপরদিকে অধাতব CI, Na কর্তৃক বর্জিত ইলেকট্রনটি গ্রহণ করে স্থিতিশীল ইলেকট্রন বিন্যাস অর্জন করে এবং Cl– আয়ন গঠন করে।
Na+ → 1s2 2s2 2p6
Cl– → 1s2 2s2 2p6 3s2 3p6
ইলেকট্রন আদান প্রদানে সৃষ্ট Na+ ও Cl– আয়নদ্বয় পরস্পর শক্তিশালী আয়নিক বন্ধন দ্বারা আবদ্ধ হয়ে সোডিয়াম ক্লোরাইড (NaCl) গঠন করে।
ICT দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
ঘ. পর্যায় সারণির প্রত্যেক গ্রুপের মৌলসমূহের মধ্যে ভৌত ও রাসায়নিক ধর্ম একই রকম।
গ্রুপ-1 এর ধাতুসমূহ খুবই সক্রিয়। এদের ধর্মের মধ্যে বেশ কিছু মিল রয়েছে। যেমন, এদের কার্বনেটসমূহ এসিডের সাথে একই রকম বিক্রিয়া দেয়। নিচে শাব্দিক সমীকরণের সাহায্যে তা দেখানো হলো—
গ্রুপ-I এর ধাতুর কার্বনেট + এসিড → লবণ + পানি + কার্বন ডাইঅক্সাইড উদাহরণ হিসেবে Na2CO3 ও K2CO3 এর সাথে HCl এর বিক্রিয়া নিম্নে দেয়া হলো :
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
K2CO3 + 2HCl → 2KCl + H2O + CO2
উপরোক্ত উভয় বিক্রিয়াতেই গ্রুপ-1 এর দুটি ভিন্ন ধাতুর (Na ও K) কার্বনেটের সাথে HCl এসিডের বিক্রিয়ার উৎপাদ হিসেবে লবণ, পানি ও কার্বন ডাইঅক্সাইড পাওয়া যায়। অর্থাৎ গ্রুপ-1 এর ধাতুসমূহের রাসায়নিক ধর্ম একই রকম।
অতএব, দেখা যাচ্ছে যে, একই গ্রুপের অবস্থিত ধাতুসমূহের রাসায়নিক ধর্ম একইরকম-উক্তিটি সম্পূর্ণরূপে সত্য।
প্রশ্ন ৬ : নিচের ছকটি দেখে প্রশ্নগুলোর উত্তর দাও :
ক. পর্যায় কাকে বলে?
খ. ফসফরাস মৌলের পর্যায় সারণিতে অবস্থান ব্যাখ্যা কর।
গ. যে কোনো পর্যায়ের মৌলের আকারের পরিবর্তন। উল্লিখিত পর্যায়টির মাধ্যমে প্রমাণ কর।
ঘ. উল্লিখিত গ্রুপটির সক্রিয়তার ক্রম H2O এর সাথে বিক্রিয়ার মাধ্যমে বিশ্লেষণ কর।
৬নং প্রশ্নের উত্তর
ক. পর্যায় সারণির আনুভূমিক সারিগুলোকে পর্যায় বলে।
খ. ফসফরাস পর্যায় সারণিতে ৩য় পর্যায়ের গ্রুপ 15 তে অবস্থান করে। কোনো মৌলের সর্ববহিস্থ শেলের ইলেকট্রন সংখ্যা অনুসারে তার গ্রুপ এবং স্তরের সংখ্যা অনুসারে পর্যায় নির্ধারণ করা হয়। ফসফরাস (15) এর ইলেকট্রন বিন্যাস 2, 8, 5। এর শেল সংখ্যা 3টি। সুতরাং, এর পর্যায় সংখ্যা 3 এবং সর্ববহিঃস্থ স্তরে ইলেকট্রন সংখ্যা 5। যেহেতু তিনটি শক্তিস্তরে বিন্যস্ত ইলেকট্রনের ক্ষেত্রে গ্রুপ সংখ্যা = সর্ববহিঃস্থ কক্ষপথের ইলেকট্রন সংখ্যা + 10।
অতএব এটি পর্যায় সারণিতে গ্রুপ-15 তে অবস্থান করবে।
গ. উল্লিখিত পর্যায়টি (Na থেকে Ar) হলো ৩য় পর্যায়।
আমরা জানি, পরমাণুর আকার পর্যায়বৃত্ত ধর্ম। যে কোনো পর্যায়ে যতই ডানদিকে যাওয়া যায়, অর্থাৎ পারমাণবিক সংখ্যা যতই বাড়ে, পরমাণুর আকার ততই হ্রাস পায়। এর কারণ হচ্ছে একই পর্যায়ে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে একটি করে ইলেকট্রন যুক্ত হয়, কিন্তু ইলেকট্রনের স্তরসংখ্যা বাড়ে না। পারমাণবিক সংখ্যা বৃদ্ধির অর্থ নিউক্লিয়াসে ধনাত্মক আধানের বৃদ্ধি। ফলে ইলেকট্রনসমূহ নিউক্লিয়াস কর্তৃক আরো জোরে আকৃষ্ট হয়। ফলে পরমাণুর ব্যাসার্ধ হ্রাস পায়।
এখানে উল্লিখিত ৩য় পর্যায়ে বিভিন্ন মৌলের পারমাণবিক ব্যাসার্ধের সাথে এসব ইলেকট্রন বিন্যাসও দেয়া হলো:
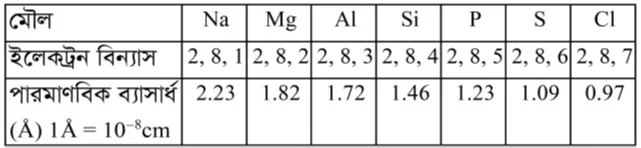
দেখা যাচ্ছে যে, প্রদত্ত পর্যায়ে Na থেকে শুরু করে Ar পর্যন্ত পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে পারমাণবিক ব্যাসার্ধ তথা পারমাণবিক আকার হ্রাস পেয়েছে।
ঘ. উল্লিখিত গ্রুপটি (F থেকে I) হলো 17নং গ্রুপ, একে হ্যালোজেন গ্রুপ বলে।
হ্যালোজেনসমূহের (F, Cl, Br, I, At) প্রথম দিকের মৌলসমূহ শক্তিশালী জারক। পর্যায় সারণির একই গ্রুপের নিচের দিকে আসতে থাকলে এদের জারণ ধর্ম তথা সক্রিয়তা কমতে থাকে। ফ্লোরিন ও ক্লোরিন অধিক শক্তিশালী জারক। ফ্লোরিন পানিকে কক্ষ তাপমাত্রায় জারিত করে প্রধানত অক্সিজেন (O2) এবং কিছু ওজোন (O3) উৎপন্ন করে।
2F2 + 2H2O = 4HF + O2
3F2 + 3H2O = 6HF + O2
এসএসসি বাংলা দ্বিতীয় পত্র সাজেশন ও বহুনির্বাচনি প্রশ্নোত্তর পেতে এখানে ক্লিক করুন
আবার, ক্লোরিন গ্যাস পানিকে জারিত করে অক্সিজেন গ্যাস উৎপন্ন করে।
2Cl2 + 2H2O = 4HCl + O2
কিন্তু হ্যালোজেন গ্রুপের নিচের দিকের সদস্য ব্রোমিন (Br) ও আয়োডিন (I) পানিকে কক্ষ তাপমাত্রায় জারিত করতে পারে না।
সুতরাং পানির সাথে বিক্রিয়ার ক্ষেত্রে আমরা উল্লিখিত গ্রুপটির সক্রিয়তার ক্রম নিম্নরূপে প্রকাশ করতে পারি।
F > Cl > Br >I → সক্রিয়তা কমছে।
প্রশ্ন –৭ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
টুম্পা রসায়ন ল্যাবে এসে দেখল দুটি মৌল পাশাপাশি রাখা আছে। যারা সক্রিয়তার দিক থেকে সম্পূর্ণ বিপরীত। পর্যায় সারণিতেও এরা ক্রম বজায় রেখেছে যাদের দ্বিতীয়টির ইলেকট্রন বিন্যাস 2, 8, 8, 1.
ক. IUPAC কী?
খ. গ্রুপ 11 তে অবস্থিত মৌলগুলোকে মুদ্রাধাতু বলা হয় কেন?
গ. টুম্পার দেখা দু’টি মৌলের সক্রিয়তা ব্যাখ্যা কর।
ঘ. উদ্দীপকের মৌল দু’টি পর্যায় সারণির মূলভিত্তির আলোচনায় কীভাবে যুক্ত তা বিশ্লেষণ কর।
৭নং প্রশ্নের উত্তর
ক. IUPAC হচ্ছে আন্তর্জাতিক রসায়ন ও ফলিত রসায়ন সংস্থা (International Union of Pure and Applied Chemistry)
খ. পর্যায় সারণিতে গ্রুপ-11 তে তামা (Cu), রূপা (Ag) ও সোনা (Au) মৌলসমূহ অবস্থিত। এদের ধাতব বৈশিষ্ট্য যেমন- উজ্জ্বলতা বিদ্যমান। ঐতিহাসিকভাবে এসব ধাতু দ্বারা মুদ্রা তৈরি করে তা ক্রয়-বিক্রয় ও অন্যান্য প্রয়োজনে বিনিময়ের মাধ্যমে হিসেবে ব্যবহার করা হয়। তাই এদেরকে মুদ্রাধাতু (Coinage metals) বলা হয়।
গ. টুম্পার দেখা দুটি মৌলের দ্বিতীয়টির ইলেকট্রন বিন্যাস 2, 8, 8, 1, অর্থাৎ পারমাণবিক সংখ্যা 19।
কাজেই মৌলটির নাম পটাসিয়াম। এর পূববর্তী মৌল, যার পারমাণবিক সংখ্যা 18, নাম হচ্ছে আর্গন। এর ইলেকট্রন বিন্যাস, 2, 8, 8। এই মৌলটির সর্ববহিঃস্থ স্তরে অষ্টক পূর্ণ রয়েছে। আমরা জানি, পরমাণুর স্বাভাবিক প্রবৃত্তি হচ্ছে সর্ববহিঃস্থ স্তরে আটটি ইলেকট্রন পূর্ণ করা। যেহেতু আর্গনের বহিঃস্থ স্তরে আটটি ইলেকট্রন রয়েছে তাই এটি নিষ্ক্রিয়।।
পক্ষান্তরে, পটাসিয়ামের বহিঃস্থ স্তরে ইলেকট্রন রয়েছে একটি। আটটি ইলেকট্রন পূরণ করার জন্য এর দরকার আরো সাতটি ইলেকট্রন যা পাওয়া অসম্ভব। তাই পটাসিয়াম একটি ইলেকট্রন ছেড়ে দিয়ে ধনাত্মক আয়নে পরিণত হয় এবং আয়নিক বন্ধনের মাধ্যমে যৌগ গঠন করে।
সুতরাং পটাসিয়াম অত্যন্ত সক্রিয় একটি ধাতু। কাজেই বলা যায়, সক্রিয়তার দিক থেকে দু’টি মৌল সম্পূর্ণ
বিপরীত প্রকৃতির।
ঘ. উদ্দীপকের মৌল দুটি অর্থাৎ পটাসিয়াম ও আর্গন পর্যায় সারণির মূলভিত্তি তথা ইলেকট্রন বিন্যাস ও পারমাণবিক সংখ্যার প্রয়োজনীয়তার আলোচনার সাথে যুক্ত।
বিজ্ঞানী ম্যান্ডেলিফ প্রথম আধুনিক পর্যায় সারণিতে মৌলসমূহকে পারমাণবিক ভরের ভিত্তিতে সাজানোর চেষ্টা করেন। কিন্তু পারমাণবিক ভরের ভিত্তিতে মৌলসমূহের বিন্যাস করলেও কিছু কিছু ব্যতিক্রম লক্ষ করা যায়। পটাসিয়াম (K) ও আর্গন (Ar) এর অবস্থান উদাহরণ হিসেবে বিবেচনা করি। পটাসিয়ামের (K) পারমাণবিক ভর 39 ও আর্গনের (Ar) পারমাণবিক ভর হলো- 40।
যদি পটাসিয়ামকে পারমাণবিক ভর অনুসারে সাজানো হয়, তাহলে আর্গনের আগে স্থান দিতে হয়। সেক্ষেত্রে পটাসিয়ামের অবস্থান হয় গ্রুপ 18 তে এবং গ্রুপ-IA-এ স্থান পায় আর্গন। বাস্তবে ভৌত ও রাসায়নিক ধর্মাবলির বিচারে পটাসিয়ামের সাথে গ্রুপ-IA-এ অবস্থিত ক্ষার ধাতুগুলোর এবং আর্গনের সাথে গ্রুপ-18-তে অবস্থিত নিষ্ক্রিয় গ্যাসের সাদৃশ্য পরিলক্ষিত হয়। কিন্তু মৌলদুটিকে পারমাণবিক সংখ্যার ভিত্তিতে সাজালে এ ধরনের জটিলতার অবসান হয়।
অতএব, উদ্দীপকের মৌল দুটি পর্যায় সারণির মূলভিত্তির আলোচনার সাথে সম্পৃক্ত।
প্রশ্ন ৮ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
A → 1s22s22p63s1
B → 1s22s22p63s23p64s1
C → 1s22s22p63s23p5
ক. আইসোটোপ কী?
খ. নিষ্ক্রিয় গ্যাস বলতে কী বুঝ?
গ. A মৌলটির গ্রুপের সদস্যদের বৈশিষ্ট্যমূলক ধর্ম ব্যাখ্যা কর।
ঘ. B এবং C মৌলদ্বয়ের গ্রুপের তুলনামূলক বৈশিষ্ট্য ব্যাখ্যা কর।
৮নং প্রশ্নের উত্তর
ক. যে সকল পরমাণুর প্রোটন সংখ্যা সমান কিন্তু ভর সংখ্যা ভিন্ন, তাদেরকে আইসোটোপ বলে।
খ. পর্যায় সারণিতে গ্রুপ-18 তে অবস্থিত মৌলসমূহকে নিষ্ক্রিয় গ্যাস বলে। এদের সর্ববহি:স্থ শক্তিস্তর প্রয়োজনীয় সংখ্যক ইলেকট্রন দ্বারা পূর্ণ থাকায় এরা ইলেকট্রন আদান-প্রদান বা শেয়ারের মাধ্যমে যৌগ গঠনে সাধারণত আগ্রহ প্রদর্শন করে না।
জীববিজ্ঞান তৃতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
গ. উদ্দীপকের A মৌলটি সোডিয়াম যা গ্রুপ-1 এ অবস্থিত। পর্যায় সারণিতে মৌলের অবস্থানের মাধ্যমে তার ভৌত ও রাসায়নিক ধর্ম সম্পর্কে সহজেই ধারণা করা যায়। যেমন গ্রুপ-1 এ অবস্থিত হাইড্রোজেন ব্যতীত অন্য মৌলগুলো হচ্ছে Li, Na, K, Rb, CS, Fr এদেরকে ক্ষারধাতু বলা হয় এবং এদের ছুরি দিয়ে কাটা যায়। সব মৌলই তার সর্ববহি:স্থ শক্তিস্তরের একটি ইলেকট্রন প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে। সবাই পানির সাথে বিক্রিয়া করে হাইড্রোজেন গ্যাস ও ক্ষার দ্রবণ উৎপন্ন করে।
এটাই A মৌল অর্থাৎ Na এর গ্রুপের সদস্যদের বৈশিষ্ট্যমূলক ধর্ম।
ঘ. ইলেকট্রন বিন্যাস থেকে দেখা যায়, B মৌলটি গ্রুপ-1 এর সদস্য যারা ক্ষারধাতু। পক্ষান্তরে C মৌলটি গ্রুপ-17 এর সদস্য যারা হ্যালোজেন। B ও C মৌলের গ্রুপের তুলনামূলক বৈশিষ্ট্য নিচে আলোচনা করা হলো:
| B মৌলটির গ্রুপ | C মৌলটির গ্রুপ |
| এই গ্রুপের সদস্যরা ধাতু। | এই গ্রুপের সদস্যরা অধাতু। |
| এরা (Be ছাড়া) পানির সাথে বিক্রিয়া করে হাইড্রোজেন তৈরি করে। | এদের কোনো কোনো সদস্য (F, CI) পানির সাথে বিক্রিয়া করে অক্সিজেন তৈরি করে। |
| Be ব্যতীত অন্য সদস্যরা পানির সাথে ক্ষার দ্রবণ তৈরি করে। | এরা প্রত্যেকেই পানির সাথে বিক্রিয়ায় এসিড তৈরি করে। |
| পানির সাথে বিক্রিয়ার ক্ষেত্রে সক্রিয়তা উপর থেকে নিচের দিকে বৃদ্ধি পায়। | পানির সাথে বিক্রিয়ার ক্ষেত্রে সক্রিয়তা উপর দিক থেকে নিচের দিকে হ্রাস পায়। |
প্রশ্ন–৯ : নিচের সারণিটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
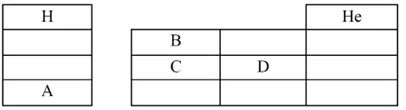
ক. ত্রয়ী সূত্রটি লিখ।
খ. অবস্তান্তর মৌলের কয়েকটি বৈশিষ্ট্য লিখ।
গ. AB ও BC যৌগ দুটির সংকেত লিখে তাদের অক্সাইড ধর্মের তুলনা কর।
ঘ. পর্যায় সারণিতে H এর অবস্থান যুক্তিযুক্ত কি? তোমার উত্তরের পক্ষে যুক্তি দাও।
৯নং প্রশ্নের উত্তর
ক. পর্যায় সারণিতে দুটি মৌলের পারমাণবিক ভরের গড় অন্য একটি মৌলের পারমাণবিক ভরের প্রায় সমান এবং মৌল তিনটির ধর্ম একই রকম।
খ. অবস্থান্তর মৌলের কয়েকটি প্রধান প্রধান বৈশিষ্ট্য নিম্নে দেওয়া হলো-
i. অবস্থান্তর মৌলসমূহের নিজস্ব বর্ণ রয়েছে।
ii. এরা ধাতব পদার্থ হিসেবে ব্যবহৃত হয়।
iii. এরা সর্ববহিঃস্থ স্তরের ইলেকট্রন প্রদান করে আয়নিক যৌগ তৈরি করে।
গ. উদ্দীপকের AB ও BC যৌগ দুটির সংকেত হলো যথাক্রমে KO2 ও SO2। নিম্নে এদের মধ্যে তুলনা দেয়া হলো-
পটাসিয়াম সুপার অক্সাইড (KO2) একটি ক্ষারধর্মী অক্সাইড। কারণ ইহা পানির সাথে বিক্রিয়ায় KOH ও O2 উৎপন্ন করে।
4KO2(s) + 2H2O (l) → 4KOH (aq) + 3O2(g)
কিন্তু SO2 একটি অম্লধর্মী অক্সাইড। কারণ ইহা পানিতে দ্রবীভূত হয়ে সালফিউরাস এসিড উৎপন্ন করে।
SO2(g) + H2O (l) = H2SO3 (aq)
উৎপন্ন H2SO3 ক্ষারের সাথে বিক্রিয়ায় লবণ ও পানি উৎপন্ন করে।
H2SO3 + 2NaOH = Na2SO3 + H2O
রসায়ন তৃতীয় অধ্যায় সাজেশন
ঘ. পর্যায় সারণিতে H এর অবস্থান নিয়ে বিতর্ক রয়েছে। গ্রুপ-I এর সদস্যগুলো হলো Na, K প্রভৃতি ক্ষার ধাতুসমূহ। তবে H এর পর্যায় সারণিতে গ্রুপ-1 এর সদস্য হিসেবে নিম্নে কিছু যুক্তি দেখানো হলো—
১. যোজ্যতা ইলেকট্রন : ক্ষার ধাতুসমূহ যেমন Li, Na, K, Rb প্রভৃতির ন্যায় হাইড্রোজেনেরও একটি মাত্র যোজ্যতা ইলেকট্রন আছে। যেমন-
Li(3) = 1s22s1
H(1) = 1s1
২. তড়িৎ ধনাত্মকতা : ক্ষারধাতুর ন্যায় H মৌলটি তড়িৎ ধনাত্মক। ফলে সহজেই ইলেকট্রন ত্যাগ করে তা ধনাত্মক হাইড্রোজেন আয়ন বা প্রোটন (H+) এ পরিণত হয়।
৩. ধাতুর মতো হ্যালাইড গঠন : ক্ষার ধাতুর ন্যায় হাইড্রোজেনও ঋণাত্মক হ্যালোজেনের সাথে যুক্ত হয়ে হ্যালাইড গঠন করে, যেমন : NaCl, HCl। আবার, যেহেতু পর্যায় সারণিতে মৌলসমূহকে পারমাণবিক সংখ্যা অনুসারে সাজানো হয়েছে। সেহেতু হাইড্রোজেনের পারমাণবিক সংখ্যা 1 হওয়ায় এর বহিঃস্থ স্তরে 1টি ইলেকট্রন থাকায় এটি গ্রুপ 1-এ স্থান পায়।
প্রশ্ন –১০ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
Q, R, S, T তিন শক্তিস্তর বিশিষ্ট চারটি মৌলের পরমাণু যাদের শেষ কক্ষপথে ইলেকট্রন আছে যথাক্রমে 1, 4, 6, 7.
ক. পর্যায় সারণি কাকে বলে?
খ. গ্রুপ-2 মৌলসমূহকে মৃৎক্ষার ধাতু বলা হয় কেন?
গ. Q, R ও T মৌল ৩টির অবসথান নির্ণয় কর।
ঘ. উদ্দীপকের মৌলগুলোর সাহায্যে প্রমাণ কর একই পর্যায়ে বামদিক থেকে ডানদিকে মৌলসমূহের ধাতব ধর্ম হ্রাস পায় অধাতব ধর্ম বৃদ্ধি পায় বিশ্লেষণ কর।
১০নং প্রশ্নের উত্তর
ক. এ পর্যন্ত আবিষ্কৃত মৌলগুলোকে তাদের ধর্ম, বৈশিষ্ট্য ও ইলেকট্রন বিন্যাস অনুযায়ী সাজানোর জন্য যে ছক ব্যবহার করা হয় তাকে পর্যায় সারণি বলে।
খ. গ্রুপ-2 এ অবস্থিত মৌলসমূহ বিভিন্ন যৌগ হিসেবে মাটিতে থাকে বলে এদের মৃৎক্ষার ধাতু বলে। গ্রুপ 2-এর Be থেকে শুরু করে Ra পর্যন্ত মৌলসমূহকে মৃৎক্ষার ধাতু বলা হয়। এদের ধর্ম অনেকটা ক্ষারধাতুর মতোই। এদের অক্সাইডসমূহ পানিতে ক্ষারীয় দ্রবণ তৈরি করে। এরাও সর্ববহি:স্থ শক্তিস্তরের ২টি ইলেকট্রন প্রদান করে আয়নিক যৌগ (লবণ) তৈরি করে।
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
গ. Q, R এবং T মৌল ৩টি তিন শক্তিস্তর বিশিষ্ট। এদের ইলেকট্রন বিন্যাস করলে প্রত্যেকের সর্বশেষ ইলেকট্রনটি তৃতীয় শক্তিস্তরে যায়। কাজেই মৌল ৩টি তৃতীয় পর্যায়ে অবস্থিত।
Q এর ইলেকট্রন বিন্যাস : 2, 8, 1 যেহেতু Q এর সর্বশেষ স্তরে ইলেকট্রন আছে 1টি, তাই এর অবস্থান গ্রুপ 1-এ।
R এর ইলেকট্রন বিন্যাস- 2, 8, 4. সর্বশেষ শক্তিস্তরে ইলেকট্রন সংখ্যা 4, কিন্তু পর্যায় সংখ্যা 3। কাজেই মৌলটি গ্রুপ সংখ্যা 4 না হয়ে হবে (4+ 10) = 14
T এর ইলেকট্রন বিন্যাস 2, 8, 7. কাজেই R মৌলের অনুরূপ কারণে এর গ্রুপ সংখ্যা হবে (7 + 10)= 17.
.:. Q, R এবং T মৌলের অবস্থান হবে পর্যায় সারণির তৃতীয় পর্যায়ে যথাক্রমে গ্রুপ-1, গ্রুপ-14 এবং গ্রুপ-17 তে।
ঘ. উদ্দীপকের মৌলগুলোর অক্সাইড থেকে প্রমাণ করা যায় একই পর্যায়ে যত বাম দিক থেকে ডানে যাওয়া যায় ততই ধাতব ধর্ম হ্রাস পায়, অধাতব ধর্ম বৃদ্ধি পায়।
Q, R, S, T মৌল চারটি হচ্ছে যথাক্রমে সোডিয়াম, সিলিকন, ফসফরাস ও ক্লোরিন। সোডিয়াম অক্সাইড ক্ষারধর্মী। পানির সাথে একই পর্যায়ের বিভিন্ন মৌলের বিক্রিয়া হতে ক্রমান্বয়ে পরিবর্তনের প্রমাণ পাওয়া যায়। যেমন-
Na2O পানির সাথে বিক্রিয়া করে NaOH উৎপন্ন করে, যা তীব্র ক্ষার।
Na2O + H2O = 2NaOH.
সিলিকন ডাই অক্সাইড পানি বা অম্লের সাথে বিক্রিয়া করে না, কিন্তু এটি ক্ষারের সাথে বিক্রিয়া করে লবণ ও পানি উৎপন্ন করে। অর্থাৎ এটি অম্লধর্মী।
SiO2 + 2NaOH = Na2SiO3 + H2O
ফসফরাস পেন্টাক্সাইড পানির সাথে বিক্রিয়া করে দুর্বল অম্ন ফসফরিক এসিড উৎপন্ন করে। ক্ষারের সাথে বিক্রিয়ায় ফসফেট লবণ ও পানি উৎপন্ন হয়।
P2O3 + 3H2O = 2H3PO4
P2O5 + 4NaOH = 2Na2HPO4 + H2O
ক্লোরিন হেপ্টাক্সাইড পানির সাথে বিক্রিয়া করে অতি শক্তিশালী অম্ল পারক্লোরিক এসিড উৎপন্ন করে। ক্ষারের সাথে বিক্রিয়ায় পারক্লোরেট লবণ ও পানি উৎপন্ন হয়।
Cl2O7 + H2O = 2HClO4
Cl2O7 + 2NaOH = 2NaClO4 + H2O

