এসএসসি রসায়ন সাজেশন
তৃতীয় অধ্যায়-পদার্থের গঠন
Structure of Matter
পাঠ সম্পর্কিত গুরুত্বপূর্ণ বিষয়াদি
প্রশ্ন : Atom বলতে কী বুঝ?
উত্তরঃ গ্রিসের দার্শনিক ডেমোক্রিটাস প্রথম বলেছিলেন, প্রত্যেক পদার্থের একক আছে যা অতি ক্ষুদ্র আর অবিভাজ্য। তিনি এর নাম দেন এটম। যার অর্থ অবিভাজ্য। কোনো বৈজ্ঞানিক পরীক্ষা দিয়ে এটি প্রমাণ করা সম্ভব হয়নি বলে এটি কোনো গ্রহণযোগ্যতা পায়নি। অবশেষে 1803 সালে ব্রিটিশ বিজ্ঞানী জন ডাল্টন বিভিন্ন পরীক্ষায় প্রাপ্ত ফলাফলের উপর ভিত্তি করে পরমাণু সম্পর্কে একটি মতবাদ দেন যে প্রতিটি পদার্থ অজস্র ক্ষুদ্র এবং অবিভাজ্য কণার সমন্বয়ে গঠিত । তিনি দার্শনিক ডেমোক্রিটাসের সম্মানে এ একক কণার নাম দেন Atom, যার অর্থ পরমাণু। এর পরে প্রমাণিত হয় যে, পরমাণু অবিভাজ্য নয়।
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন : মৌলিক পদার্থ ও যৌগিক পদার্থ কাকে বলে? উদাহরণ দাও।
উত্তরঃ মৌলিক পদার্থ: যে পদার্থকে ভাঙলে বা বিশ্লেষণ করলে সেই পদার্থ ছাড়া পৃথক ধর্মবিশিষ্ট অন্য কোনো নতুন পদার্থ পাওয়া যায় না তাকে মৌলিক পদার্থ বা মৌল বলে। যেমন- নাইট্রোজেন, ফসফরাস, কার্বন, অক্সিজেন, হিলিয়াম, ক্যালসিয়াম, আর্গন, ম্যাগনেসিয়াম, সালফার প্রভৃতি মৌলিক পদার্থ। এ পর্যন্ত 118 টি মৌল আবিষ্কৃত হয়েছে। এগুলোর মধ্যে 98 টি মৌল প্রকৃতিতে পাওয়া যায়। বাকি মৌলগুলো কৃত্রিম মৌল বা গবেষণাগারে তৈরি করা হয়েছে। আমাদের শরীরে মোট 26 ধরনের ভিন্ন ভিন্ন মৌল আছে।
যৌগিক পদার্থঃ যে সকল পদার্থকে ভাঙলে দুই বা দুইয়ের অধিক মৌল পাওয়া যায় তাদেরকে যৌগিক পদার্থ বলে। যেমন- পানি একটি যৌগিক পদার্থ। কারণ, পানিকে রাসায়নিক ভাবে ভাঙলে বা বিশ্লেষণ করলে সব সময় দুই ভাগ হাইড্রোজেন এবং এক ভাগ অক্সিজেন পাওয়া যাবে। অর্থাৎ পানিতে হাইড্রোজেন ও অক্সিজেনের পরমাণুর সংখ্যার অনুপাত 2:1 এবং ভরের অনুপাত 1: 8 ।
সুতরাং পানি একটি যৌগিক পদার্থ।
প্রশ্ন : পরমাণু ও অণু কাকে বলে? উহাদের মধ্যে পার্থক্য লিখ।
উত্তরঃ পরমাণু: কোন মৌলিক পদার্থের অতি ক্ষুদ্রতম কণা যার মধ্যে ঐ মৌলিক পদার্থের বৈশিষ্ট্য বিদ্যমান থাকে তাকে ঐ মৌলের পরমাণু বলে।
অণু: মৌলিক বা যৌগিক পদার্থের ক্ষুদ্রতম কণা যার স্বাধীন অস্তিত্ব আছে এবং ঐ পদার্থের গুণাবলি অক্ষুন্ন রেখে মুক্ত অবস্থায় থাকতে পারে তাকে অণু বলে। অণু দুই প্রকার। যথা-
মৌল অণু: একই মৌলের পরমাণু পরস্পর যুক্ত হলে তাকে মৌলের অণু বলে। যেমন-O2, N2, H2, Na ইত্যাদি।
যৌগঅণু : ভিন্ন ভিন্ন মৌলের পরমাণু পরস্পর যুক্ত হলে তাকে যৌগের অণু বলে। যেমন- CO2, H2O, HCl ইত্যাদি।
পরমাণু ও অণুর মধ্যে পার্থক্য নিম্নে দেওয়া হলো:
| পরমাণু | অণু |
| ১. মৌলিক পদার্থের ক্ষুদ্রতম কণা। | ১. মৌলিক বা যৌগিক পদার্থের ক্ষুদ্রতম কণা। |
| ২. স্বাধীন অস্তিত্ব নেই। | ২. স্বাধীন অস্তিত্ব আছে। |
| ৩. সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করতে পারে। | ৩. পরমাণুতে বিশ্লিষ্ট না হয়ে সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করতে পারে না। |
| ৪. পরমাণুকে ভাঙলে ইলেকট্রোন, প্রোটন ও নিউট্রন পাওয়া যায়। | ৪. অণুকে ভাঙলে পরমাণু পাওয়া যায়। |
প্রশ্ন ৪ প্রতীক কাকে বলে? প্রতীক লিখার নিয়মগুলি লিখ।
উত্তরঃ প্রতীক : কোনো একটি মৌলের ইংরেজি বা ল্যাটিন নামের সংক্ষিপ্ত রূপকে ঐ মৌলের প্রতীক বলে। প্রতিটি মৌলের প্রতীক একটি অন্যটি থেকে ভিন্ন। যেমন : সোডিয়াম এর প্রতীক Na, সালফার এর প্রতীক S, ব্রোমিন (Bromine) এর প্রতীক Br; বোরন (Boron) এর প্রতীক B ইত্যাদি।
ICT দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
প্রতীক লেখার নিয়ম: সাধারণত মৌলের ল্যাটিন বা ইংরেজী নামের প্রথম এক বা একাধিক ইংরেজী বর্ণ দ্বারা প্রতীক লেখা হয়।
i. মৌলের ইংরেজি নামের প্রথম অক্ষর দিয়ে প্রতীক লেখা হয় এবং তা ইংরেজি বড় হাতের অক্ষর দিয়ে প্রকাশ করা হয়। যেমন- হাইড্রোজেনের (Hydrogen) প্রতীক H , অক্সিজেনের (Oxygen) প্রতীক O, কার্বনের (Carbon) প্রতীক C ইত্যাদি।
ii. যদি দুই বা দুইয়ের অধিক মৌলের ইংরেজি নামের প্রথম অক্ষর একই হয় তবে একটি মৌলকে নামের প্রথম অক্ষর ইংরেজি বড় হাতের দিয়ে প্রকাশ করা হয়। অন্যগুলোর ক্ষেত্রে প্রতীকটি দুই অক্ষরে লেখা হয়। নামের প্রথম অক্ষরটি ইংরেজি বড় হাতের অক্ষর এবং নামের অন্য একটি অক্ষর ছোট হাতের অক্ষর দিয়ে লেখা হয়। যেমন-ক্লোরিন (Cholorine) এর প্রতীক Cl, ক্যালসিয়ামের (Calcium) এর প্রতীক Ca, নিকেল (Nickel) এর প্রতীক Ni, জিংক (Zinc) এর প্রতীক Zn , ব্রোমিন (Bromine) এর প্রতীক Br ইত্যাদি।
iii. কিছু মৌলের প্রতীক তাদের ল্যাটিন নাম থেকে নেওয়া হয়েছে। যেমন- সোডিয়াম (Natrium এর প্রতীক Na, লেড (Plumbum) এর প্রতীক Pb, সিলভারের (Argentum) প্রতীক Ag, পটাসিয়ামের (Kalium) প্রতীক K ইত্যাদি।
প্রশ্ন ৪ সংকেত বলতে কী বুঝ? সংকেতের তাৎপর্য লিখ।
উত্তরঃ সংকেত: অণুর সংক্ষিপ্ত রূপকে সংকেত বলে। অর্থাৎ কোন মৌলিক বা যৌগিক পদার্থের অণুকে সংশ্লিষ্ট মৌলের প্রতীক ও উহাদের পরমাণুর সংখ্যার সাহায্যে সংক্ষিপ্ত রূপে প্রকাশ করাকে মৌলিক বা যৌগিক পদার্থের সংকেত বলে। সংকেত থেকে একটি মৌলের নির্দিষ্ট সংখ্যক পরমাণু অপর মৌলের কতটি পরমাণুর সাথে যুক্ত থাকে তা জানা যায়। যেমন- CO2 অণু কার্বন ও অক্সিজেন মৌলের সমন্বয়ে গঠিত। কার্বনের একটি পরমাণু অক্সিজেনের দুটি পরমাণুর সাথে যুক্ত হয়ে CO2 গঠিত হয়।
সংকেতের তাৎপর্য : আণবিক সংকেতের দু’ধরনের তাৎপর্য আছে;
i. গুণগত তাৎপর্য এবং ii. পরিমাণগত তাৎপর্য।
গুণগত তাৎপর্য :
i. কোণ সংকেত দ্বারা একটি নির্দিষ্ট বস্তু বুঝায়। যেমন- H2O সংকেত দ্বারা একটি নির্দিষ্ট বস্তু পানিকে বুঝায়।
ii. সংকেত দ্বারা বস্তুটি কি কি মৌল দ্বারা গঠিত তা বুঝায়। যেমন- H2O সংকেত দ্বারা বুঝা যায় যে বস্তুটি হাইড্রোজেন ও অক্সিজেন এ দুটি মৌল দ্বারা গঠিত।
পরিমাণগত তাৎপর্য :
i. আণবিক সংকেত সংশ্লিষ্ট পদার্থের একটি অণুকে নির্দেশ করে। যেমন-আণবিক সংকেত H2O দ্বারা পানির একটি অণু বুঝায়।
ii. আণবিক সংকেত দ্বারা অণুস্থিত বিভিন্ন মৌলের পরমাণুর সঠিক সংখ্যা জানা যায়। যেমন- পানির আণবিক সংকেত H2O দ্বারা বুঝা যায়, পানির অণুতে 2 পরমাণু হাইড্রোজেন ও 1 পরমাণু অক্সিজেন আছে।
iii. আণবিক সংকেত দ্বারা পদার্থটির আণবিক ভর জানা যায়। যেমন- পানির আণবিক সংকেত H2O দ্বারা উহার আণবিক ভর (1×2+16)=18 বুঝা যায়।
প্রশ্ন : পরমাণুর গঠন বর্ণনা কর।
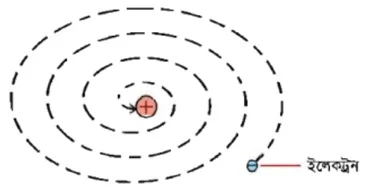
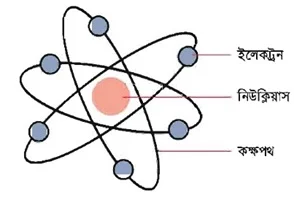
উত্তর : পরমাণু বিভিন্ন প্রকার স্থায়ী ও অস্থায়ী অতি সূক্ষ মৌলিক কণিকা দ্বারা গঠিত। ইলেকট্রন, প্রোটন ও নিউট্রন এই তিনটি কণিকা অতীব স্থায়ী এবং হাইড্রোজেন ব্যতীত সব পরমাণুতে এই তিনটি কণিকা পাওয়া যায়। বাকী কণিকাগুলো অস্থায়ী বা সব পরমাণুতে পাওয়া যায় না।
1911 সালে রাদারফোর্ড প্রমাণ করেন যে, পরমাণুর একটি কেন্দ্র আছে, যার নাম তিনি রাখেন নিউক্লিয়াস। এ নিউক্লিয়াসে প্রোটন ও নিউট্রন অবস্থান করে। সুতরাং পরমাণুর সকল ধনাত্মক আধান এবং প্রায় সম্পূর্ণ ভরই নিউক্লিয়াসে কেন্দ্রীভূত। ইলেকট্রন নিউক্লিয়াসের বাইরে থাকে এবং তার চারিদিকে ঘূর্নায়মান অবস্থায় ভ্রমন করে। নিউক্লিয়াস পরমাণুর তুলনায় অতি ক্ষুদ্র।
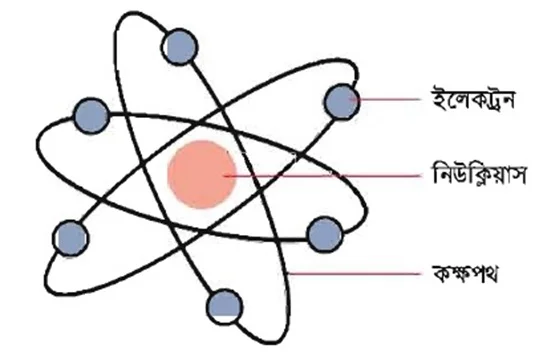
একটি পরমাণুর ব্যাস 10-8cm এবং একটি নিউক্লিয়াসের ব্যাস 10-10 m । পরমাণুতে প্রোটন ও ইলেকট্রন সংখ্যা সমান থাকার জন্য পরমাণু তড়িৎ নিরপেক্ষ ।
ICT দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন : মৌলিক কণিকা বলতে কী বুঝ? মৌলিক কণিকা সমূহের বর্ণনা দাও।
উত্তর : মৌলিক কণিকা : যে সকল অতি সূক্ষ্ম কণিকা দ্বারা পরমাণু গঠিত, তাদেরকে মৌলিক কণিকা বা মূল কণিকা বলা হয়। স্থায়ী কণিকা তিনটি। যথা- প্রোটন, ইলেকট্রন ও নিউট্রন। এ পর্যন্ত পরমাণুতে দুই শতাধিক কণিকা আবিষ্কৃত হয়েছে।
ইলেকট্রন : 1897 সালে বৃটিশ বিজ্ঞানী স্যার জে. জে. থমসন পরমাণুতে ইলেকট্রনের অস্তিত্ব আবিষ্কার করেন।
ইলেকট্রনের বৈশিষ্ট্যসমূহ :
i. ইলেকট্রনের ঋণাত্মক চার্জ রয়েছে। এই আধান বা চার্জের পরিমাণ -1.60 x10-19 কুলম্ব ।
ii. ইলেকট্রনের প্রকৃত ভর = 9.110 x 10-28 গ্রাম, যা একটি প্রোটন বা হাইড্রোজেন পরমাণুর ভরের 1/1840 ভাগ।
iii. ইলেকট্রসমূহ পরমাণুর নিউক্লিয়াসের চতুর্দিকে নির্দিষ্ট কক্ষপথে আবর্তন করতে থাকে।
iv. ইলেকট্রনকে ‘e’ প্রতীক দ্বারা প্রকাশ করা হয়।
v. এটি ঋণাত্মক আধানযুক্ত এবং এর আপেক্ষিক আধানকে -1 ধরা হয়।
vi. রাসায়নিক বিক্রিয়ার সময় ইলেকট্রন এক পরমাণু থেকে অন্য পরমাণুতে গমন করতে পারে।
প্রোটন : 1919 সালে নিউজিল্যান্ডের পদার্থ বিজ্ঞানী রাদারফোর্ড পরমাণুতে প্রোটনের অস্তিত্ব আবিষ্কার করেন।
প্রোটনের বৈশিষ্ট্যসমূহ :
i. প্রোটনের ধনাত্মক চার্জ রয়েছে। এই চার্জের পরিমাণ +1.60 x 10-19 কুলম্ব ।
ii. একটি প্রোটনের প্রকৃত ভর = 1.673 x10-24 গ্রাম, যা একটি হাইড্রোজেন পরমাণুর ভরের সমান।
iii. প্রোটনের ভর ইলেকট্রনের চেয়ে প্রায় 1840 গুণ বেশি।
iv. প্রোটন, পরমাণুর নিউক্লিয়াসে অবস্থান করে।
v. প্রোটনের সংকেত p এর আরেকটি সংকেত H+ ।
vi. এটি ধনাত্মক আধানযুক্ত এবং এর আপেক্ষিক আধানকে +1 ধরা হয়।
vii. রাসায়নিক বিক্রিয়ার সময় প্রোটন এক পরমাণু থেকে অন্য পরমাণুতে গমন করতে পারে না।
নিউট্রন : 1932 সালে বৃটিশ বিজ্ঞানী চ্যাডউইক পরমাণুতে নিউট্রনের অস্তিত্ব আবিষ্কার করেন। সাধারণত হাইড্রোজেন ব্যতীত অন্য যে কোন মৌলের পরমাণুতে নিউট্রন বিদ্যমান।
নিউট্রনের বৈশিষ্ট্যসমূহ :
i. নিউট্রনের কোন চার্জ নেই। এ জন্যেই এর নাম নিউট্রন (নিরপেক্ষ)।
ii. নিউট্রনের প্রকৃত ভর 1.675 × 10 -24 গ্রাম যা প্রোটনের ভরের চেয়ে সামান্য বেশী।
iii. নিউট্রন পরমাণুর নিউক্লিয়াসে প্রোটনের সাথে অবস্থান করে।
iv. নিউট্রনকে n দ্বারা প্রকাশ করা হয়।
v. এটি চার্জ নিরপেক্ষ এবং আপেক্ষিক ভর 1 ধরা হয়।
vi. প্রোটন ও নিউট্রনের আপেক্ষিক ভর সমান।
vii. একই মৌলের বিভিন্ন পরমাণুর মধ্যে নিউট্রনের সংখ্যার বিভিন্নতার কারণে আইসোটোপ সৃষ্টি হয়।
প্রশ্ন : ইলেকট্রন, প্রোটন ও নিউট্রনের মধ্যে তুলনা মূলক পার্থক্য লিখ।
উত্তর : ইলেকট্রন, প্রোটন ও নিউট্রনের মধ্যে পার্থক্য নিম্নে দেখানো হলো :
| পার্থক্যের বিষয় | ইলেকট্রন | প্রোটন | নিউট্রন |
| প্রতীক | e | p | n |
| আপেক্ষি ভর | 1/1840 বা 0 | 1 | 1 |
| আপেক্ষিক আধান | -1 | +1 | 0 |
| প্রকৃত ভর | 9.110 x 10 -28g | 1.673 x 10 -24g | 1.675 × 10 -24g |
| প্রকৃত আধান বা চার্জ | -1.602 × 10 -19 কুলম্ব | +1.602 x 10 -19 কুলম্ব | 0 |
| অবস্থান | নিউক্লিয়াসে বাইরে কক্ষপথে পরিভ্রমণ করে। | নিউক্লিয়াসে | নিউক্লিয়াসে |
| আবিষ্কারক ও সাল | জে.জে. থমসন-১৮৯৭ সালে। | রাদারফোর্ড-1919 সালে। | চ্যাডউইক-1932 সালে। |
প্রশ্ন : পারমাণবিক সংখ্যা ও পরমাণুর ভরসংখ্যা বা নিউক্লিয়ন সংখ্যা কাকে বলে?
উত্তর : পারমাণবিক সংখ্যা : কোনো মৌলের পরমাণুর নিউক্লিয়াস বা কেন্দ্রে যতসংখ্যক প্রোটন থাকে, সেই সংখ্যাকে ঐ মৌলের পারমাণবিক সংখ্যা বলে। এটি একটি পরমাণুর নিজস্ব সত্তা বা তার পরিচয়। সাধারণত মৌলের প্রতীকের বামপাশে নিচের দিকে প্রোটন সংখ্যা তথা পারমাণবিক সংখ্যা লেখা হয়। একে z দ্বারা প্রকাশ করা হয়।
হিলিয়ামে 2টি প্রোটন আছে। সুতরাং এর পারমাণবিক সংখ্যা 2। তাই হিলিয়ামকে 2He লিখে প্রকাশ করা হয়।
পরমাণুর ভরসংখ্যা : কোনো মৌলের একটি পরমাণুর নিউক্লিয়াসের মধ্যে প্রোটন এবং নিউট্রনের মোট সংখ্যাকে ঐ মৌল বা পরমাণুর ভর সংখ্যা বা নিউক্লিয়ন সংখ্যা বলে বলে।
অর্থাৎ ভর সংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা। একে A দ্বারা প্রকাশ করা হয়।
এটিকে মৌলের প্রতীকের বামপাশে ওপর দিকে লিখা হয়। যেমন, ইউরেনিয়ামের ভর সংখ্যা 238।
সুতরাং, একে 238U লিখে প্রকাশ করা হয়।
আবার, ক্লোরিনের পারমাণবিক ভর 35।
কেননা, ক্লোরিনের একটি পরমাণুতে 17টি প্রোটন ও 18টি নিউট্রন বিদ্যমান।
অর্থাৎ ভর সংখ্যা = 17+18=35
প্রশ্ন : চার্জ কী?
উত্তর : পরমাণুর গঠন সৃষ্টিকারী মৌলিক কণাসমূহের যেমন ইলেকট্রন ও প্রোটনের মৌলিক ও বৈশিষ্টমূলক ধর্মকে চার্জ বলে।
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন : পরমাণু বিদ্যুৎ নিরপেক্ষ কেন?
উত্তর : পরমাণুর নিউক্লিয়াসে ধনাত্মক চার্জ বিশিষ্ট যতটি প্রোটন বিদ্যমান, নিউক্লিয়াসের বাইরের কক্ষপথে ঠিক ততটি ঋণাত্মক চার্জ বিশিষ্ট ইলেকট্রন বিদ্যমান। ধনাত্মক ও ঋণাত্মক চার্জ বিপরীতমুখী এবং সমান হওয়ার কারণে পরমাণু বিদ্যুৎ নিরপেক্ষ।
প্রশ্ন : আপেক্ষিক পরমাণবিক ভর বলতে কী বুঝ? ইহার কোন একক নেই কেন?
উত্তর : আপেক্ষিক পারমাণবিক ভর : কোনো মৌলের আইসোটোপগুলোর শতকরা পর্যাপ্ততার পরিমাণকে গড় করলে যে ভর পাওয়া যায় তাকে ঐ মৌলের আপেক্ষিক পারমাণবিক ভর বলে।
সাধারণ অবস্থায় মৌলের আইসোটোপগুলো এমন অনুপাতে থাকে যে, এগুলোর ভরের গড় হিসেবে পারমাণবিক ভর পূর্ণসংখ্যার না হয়ে ভগ্নাংশ হয়। যেমন- ক্লোরিনের দুটি আইসোটোপ হলো-
35Cl এবং 37Cl। এদের প্রত্যেকের ভর পূর্ণসংখ্যার হয়। কিন্তু পর্যাপ্ততার দিক থেকে এদের শতকরা পরিমাণ যথাক্রমে 75% এবং 25%। তাই ক্লোরিনের আপেক্ষিক পারমাণবিক ভর 35.5।

আবার, কোন একটি মৌলের পরমাণুর ভরকে প্রমাণ বা স্ট্যান্ডার্ড হিসেবে ধরে তার সাপেক্ষে বিভিন্ন মৌলের এক একটি পরমাণু কতগুণ ভারী তা নির্ণয় করা হয়। একেই সংশ্লিষ্ট মৌলের আপেক্ষিক পারমাণবিক ভর বলা হয়।
অর্থাৎ কোন মৌলের একটি পরমাণুর ভর কার্বন 12 আইসোটোপের ভরের 1/12 অংশের তুলনায় যতগুণ ভারী সে সংখ্যাকে সংশ্লিষ্ট মৌলের আপেক্ষিক পারমাণবিক ভর বলে।

যেমন- অক্সিজেনের আপেক্ষিক পারমাণবিক ভর 16। এর অর্থ হচ্ছে একটি অক্সিজেন পরমাণুর ভর কার্বন 12 আইসোটোপের ভরের 1/12 অংশের তুলনায় 16 গুণ ভারী।
মৌলের একটি পরমাণুর প্রকৃত ভরকে 1.66 X 10-24 গ্রাম দ্বারা ভাগ করে আপেক্ষিক পারমাণবিক ভর বের করা যায়। যেমন: Al এর 1টি পরমাণুর ভর 4.482 x 10-23 গ্রাম।
কাজেই Al মৌলের আপেক্ষিক পারমাণবিক ভর = 4.482×10-23গ্রাম/1.66×10-24 গ্রাম = 27 ।
আপেক্ষিক পারমাণবিক ভরের কোনো একক নেই। কারণ একই জাতীয় দুইটি রাশির অনুপাত বলে ইহার কোন একক নেই।
প্রশ্ন : আপেক্ষিক আণবিক ভর বলতে কী বুঝ?
উত্তর : আপেক্ষিক আণবিক ভর : কোনো পদার্থের অণুতে বিদ্যমান পরমাণুসমূহের আপেক্ষিক পারমাণবিক ভরের সমষ্টিকে আপেক্ষিক আণবিক ভর বলা হয়।
যেমন : অক্সিজেনের আপেক্ষিক পারমাণবিক ভর 16। একটি অক্সিজেন অণু অক্সিজেনের 2টি পরমাণু নিয়ে গঠিত। সুতরাং অক্সিজেনের আপেক্ষিক আণবিক ভর হবে 16 x2 = 32।
আবার, কোন বস্তুর একটি অণুর প্রকৃত ভর ও কার্বন 12 আইসোটোপের ভরের 1/12 অংশের তুলনাকে আপেক্ষিক আণবিক ভর বলে।
অর্থাৎ আপেক্ষিক আণবিক ভর = বস্তুর একটি অণুর প্রকৃত ভর/কার্বন-12 আইসোটোপের ভরের 1/12 অংশ
আপেক্ষিক আণবিক ভরেরও কোন একক নেই।
আপেক্ষিক আনবিক ভর নির্ণয় :
সাধারণত অণুতে অবস্থিত বিভিন্ন বা একই পরমাণুসমূহের আপেক্ষিক পারমাণবিক ভরসমূহকে অণুতে উপস্থিত স্ব-স্ব পরমাণুর সংখ্যা দ্বারা গুণ করে যোগ করলেই যৌগটির বা অণুটির আপেক্ষিক আণবিক ভর পাওয়া যায়।
যেমন- CaCO3 অণুর আপেক্ষিক আণবিক ভর = 1 x 40 + 1 x 12 + 3 x 16 = 100।
প্রশ্ন : আইসোটোপের শতকরা হার থেকে মৌলের গড় আপেক্ষিক ভর নির্ণয় কর।
উত্তর : প্রকৃতিতে বেশির ভাগ মৌলেরই একাধিক আইসোটোপ রয়েছে। তাই যে মৌলের একাধিক আইসোটোপ আছে সেই মৌলের সকল আইসোটোপের প্রকৃতিতে প্রাপ্ত শতকরা হার থেকে মৌলের গড় আপেক্ষিক ভর এর মান নিচের ধাপগুলো অনুসরণ করে হিসাব করা হয়।
ধাপ-১: প্রথমে কোনো মৌলের প্রত্যেকটি আইসোটোপের ভর সংখ্যা এবং প্রকৃতিতে প্রাপ্ত ঐ আইসোটোপের শতকরা পরিমাণ গুণ দিতে হবে।
ধাপ-২: প্রাপ্ত গুণফলগুলোকে যোগ করতে হবে।
ধাপ-৩: প্রাপ্ত যোগফলকে 100 দ্বারা ভাগ করলেই ঐ মৌলের গড় আপেক্ষিক ভর পাওয়া যাবে।
ধরা যাক, একটি মৌল A এর দুটি আইসোটোপ আছে। একটি আইসোটোপের ভর সংখ্যা p প্রকৃতিতে প্রাপ্ত ঐ আইসোটোপের শতকরা পরিমাণ m, অপর আইসোটোপের ভর সংখ্যা q প্রকৃতিতে প্রাপ্ত ঐ আইসোটোপের শতকরা পরিমাণ n. তাহলে-
মৌল A এর গড় আপেক্ষিক পারমাণবিক ভর = (p x m + q x n)/100.
প্রশ্ন : আইসোটোপ বলতে কি বুঝ? উদাহরণ সহ ব্যাখ্যা কর।
উত্তর : আইসোটোপ : একই মৌলের বিভিন্ন পরমাণু যাদের পারমাণবিক সংখ্যা বা প্রোটন সংখ্যা একই, কি ভর সংখ্যা বিভিন্ন হয়, তাদের আইসোটোপ বলে। নিউট্রন সংখ্যার ভিন্নতার কারণে এমন হয়। যেমন : হাইড্রোজেনের সাতটি আইসোটোপ আছে তার মধ্যে প্রকৃতিতে হাইড্রোজেনের তিনটি আইসোটোপ আছে। এদের নাম হাইড্রোজেন, ডিউটেরিয়াম ও ট্রিটিয়াম। এদের ভর সংখ্যা যথাক্রমে 1, 2 ও 3। এদের প্রত্যেকের নিউক্লিয়াসে 1টি করে প্রোটন বর্তমান অর্থাৎ প্রত্যেকের পারমাণবিক সংখ্যা 1। কিন্তু, এদের নিউক্লিয়াসে নিউট্রনের সংখ্যা প্রথমটিতে নেই, দ্বিতীয়টিতে 1 এবং তৃতীয়টিতে 2। এজন্য তিন রকম হাইড্রোজেন পরমাণু পাওয়া যায়।

আইসোটোপের বৈশিষ্ট্য :
১. এরা একই মৌলের পরমাণু।
২. এদের পারমাণবিক সংখ্যা বা প্রোটন সংখ্যা সমান, কিন্তু ভর সংখ্যা ভিন্ন, তাই নিউট্রন সংখ্যা ভিন্ন।
৩. আইসোটোপসমূহ একই মৌলের পরমাণু হওয়ায় পর্যায় সারণিতে এরা একই অবস্থানে থাকে।( iso অর্থ একই, tope অর্থ স্থান। এটি গ্রীক শব্দ)।
৪. এদের রাসায়নিক ধর্ম একই, তবে কতিপয় ভৌত ধর্মে পার্থক্য পরিলক্ষিত হয়।
ICT প্রথম অধ্যায় বহুনির্বাচনি সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন : আইসোবার, আইসোটোন ও আইসোমার বলতে কী বুঝ?
উত্তরঃ আইসোবারঃ যে সকল পরমাণুর ভর সংখ্যা সমান কিন্তু প্রােটন সংখ্যা বা পারমাণবিক সংখ্যা ভিন্ন তাদেরকে পরস্পরের আইসোবার বলে।
বৈশিষ্ট্য :
১. আইসোরগুলো ভিন্ন ভিন্ন মৌলের পরমাণু।
২. এদের ভর সংখ্যা সামান, কিন্তু পারমাণবিক সংখ্যা ভিন্ন, তাই এদের প্রােটন সংখ্যা ও নিউট্রন সংখ্যা ভিন্ন। ৩. পর্যায় সারণিতে এরা ভিন্ন ভিন্ন অবস্থানে থাকে।
৪. এদের সকল ভৌত ও রাসায়নিক ধর্ম ভিন্ন।
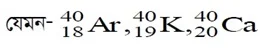
কেননা Ar, K এবং Ca এর পারমাণবিক সংখ্যা ভিন্ন (যথাক্রমে 18, 19, 20) এবং নিউট্রন সংখ্যাও ভিন্ন (যথাক্রমে 22, 21, 20)। কিন্তু ভর সংখ্যা অভিন্ন (সকলের ক্ষেত্রে 40)।
আইসােটোন : যে সব পরমাণুর নিউক্লিয়াসে নিউট্রন সংখ্যা সমান থাকে কিন্তু প্রােটন সংখ্যা ও ভর সংখ্যা ভিন্ন, তাদেরকে একে অপরের আইসােটোন বলে। আইসােটোনগুলাে ভিন্ন মৌলের পরমাণু। আইসােটোনগুলাে রাসায়নিক ধর্মও পৃথক হয়। যেমন-

আইসােমার : দুটি যৌগের আণবিক সংকেত একই কি গাঠনিক সংকেত ভিন্ন হলে তাদেরকে পরস্পরের আইসােমার বলা হয়। যেমন- ইথানল ও ডাইমিথাইল ইথারের আণবিক সংকেতঃ C2H6O কিন্তু ইথানলের গাঠনিক সংকেত : CH3 -CH2 -OH এবং ডাইমিথাইল ইথারের গাঠনিক সংকেত : CH3 – O -CH3 ।
অতএব ইহারা পরস্পরের আইসােমার বা সমাণু। আর এই ধর্মকে আইসােমারিসোম বা সমাণুতা বলে।
প্রশ্ন : আইসােটোপ, আইসােবার ও আইসােটোনের তুলনা।
উত্তর : আইসােটোপ, আইসােবার ও আইসােটোনের তুলনা নিম্নে দেওয়া হলো:
| ভরসংখ্যা | পারমাণবিক সংখ্যা | নিউট্রনসংখ্যা | পরমাণু | |
| আইসােটোপ | বিভিন্ন | একই | বিভিন্ন | একই মৌলেরপরমাণু। |
| আইসােবার | একই | বিভিন্ন | বিভিন্ন | ভিন্ন মৌলের পরমাণু |
| আইসােটোন | বিভিন্ন | বিভিন্ন | একই | ভিন্ন মৌলের পরমাণু |
প্রশ্ন : তেজস্ক্রিয়তা ও তেজস্ক্রিয়আইসােটোপ কাকে বলে? তেজস্ক্রিয়আইসােটোপ এর ব্যবহার এবং এর ক্ষতিকর প্রভাব গুলি লিখ?
উত্তর : তেজস্ক্রিয়তা : যে ধর্মের প্রভাবে সাধারণত ভারী মৌলের পরমাণুর নিউক্লিয়াস যে কোন অবস্থায়, নিজে থেকেই স্বতঃস্ফূর্তভাবে অবিরাম গতিতে বিভাজিত হয়ে নতুন মৌলের পরমাণুর নিউক্লিয়াসে পরিণত হয় এবং সেই সঙ্গে বিশেষ ধরণের অদৃশ্য রশ্মি [α (আলফা), B (বিটা), Y (গামা)] বিকিরণ করে, মৌলের সেই ধর্মকে তেজস্ক্রিয়তা বলে। এ ধরনের বিশেষ গুণবিশিষ্ট রশ্মিকে তেজস্ক্রিয় রশ্মি এবং যে মৌলগুলাের মধ্যে এই তেজস্ক্রিয় ধর্ম দেখা যায়, তাদের তেজস্ক্রিয় মৌল বলে। যেমন-ইউরেনিয়াম, রেডিয়াম ইত্যাদি।
তেজস্ক্রিয় আইসােটোপ : প্রাকৃতিক ও কৃত্রিম উপায়ে তৈরি সুস্থিত ও অস্থিত আইসােটোপগুলাের মধ্যে অস্থিত আইসােটোপগুলাে স্বতঃস্ফূর্তভাবে বিভিন্ন ধরনের রশ্মি বিকিরণ করে অন্য মৌলের আইসােটোপে পরিণত হয়। এই ধরনের আইসােটোপগুলােকে তেজস্ক্রিয় আইসােটোপ বলা হয়। প্রকৃতপক্ষে এসব মৌলের পরমাণুর নিউক্লিয়াসে পরিবর্তন ঘটে। অর্থাৎ যে সব অস্থিত আইসােটোপীয় পরমাণুর নিউক্লিয়াস স্বতঃস্ফূর্তভাবে তেজস্ক্রিয় রশ্মি বিকিরণ করে অপর কোন মৌলের কোন অস্থিতিশীল আইসােটোপে পরিণতহয়, তাদের তেজস্ক্রিয় আইসােটোপ বলে।উদাহরণ :

তেজস্ক্রিয় আইসােটোপের ব্যবহার : তেজস্ক্রিয় আইসােটোপের ব্যবহার নিম্নে দেওয়া হলাে:
কৃষিক্ষেত্রে : তেজস্ক্রিয় রশ্মি ব্যবহার করে কৃষিক্ষেত্রে নতুন নতুন উন্নত মানের বীজ উদ্ভাবন করা হচ্ছে। এ প্রক্রিয়ায় ফলনের মানের উন্নতি ও পরিমাণ বাড়ানাে হচ্ছে।গাইগার কাউন্টার তেজস্ক্রিয় 32P যুক্ত ফসফেট দ্রবণ উদ্ভিদের মূলধারায় সূচিত করা হয়। গাইগার কাউন্টার ব্যবহার করে, পুরাে উদ্ভিদে এর চলাচল চিহ্নিত করে ফসফরাস ব্যবহার করে উদ্ভিদের বেড়ে ওঠার কৌশল নির্ণয় করা হয়।
চিকিৎসা ক্ষেত্রে: চিকিৎসাক্ষেত্রে বর্তমানে বিভিন্ন প্রয়ােজনে তেজস্ক্রিয় আইসােটোপ ব্যবহার করা হচ্ছে। যেমন-রােগ নির্ণয়ে: আইসােটোপ ব্যবহার করে রােগাক্রান্ত স্থানের ছবি তােলা সম্ভব। এপদ্ধতিতে ইঞ্জেকশনের মাধ্যমে তেজস্ক্রিয় আইসােটোপ টেকনিশিয়াম 99 (99Tc) কে শরীরের ভেতরে প্রবেশ করিয়ে রােগ নির্ণয় করা হয়। সর্বপ্রথম থাইরয়েড ক্যানসার নিরাময়ে তেজস্ক্রিয় আইসােটোপ ব্যবহার কর হয়। রােগীকে পরিমাণমতাে তেজস্ক্রিয় আইসােটোপ 131I সমৃদ্ধ দ্রবণ পান করানাে হয়। এই আইসােটোপ থেকে বিটা রশ্মি নির্গত হয় এবং থাইরয়েডের ক্যানসার কোষকে ধ্বংস করে। এ ছাড়া ইরিডিয়াম আইসােটোপ ব্রেইন ক্যানসার নিরাময়ে ব্যবহার করা হয়। টিউমারের উপস্থিতি ও নিরাময়ে তেজস্ক্রিয় আইসােটোপ 60Co ব্যবহার করা হয়। রক্তের লিউকেমিয়া রােগের চিকিৎসায় 32P এর ফসফেট ব্যবহার করা হয়। 153Sm অথবা ৪9Sr ব্যবহার করে হাড়ের ব্যথার চিকিৎসা করা হয়। হার্টে পেইসমেকার বসাতে প্লুটোনিয়াম 238 ব্যবহৃত হয়।
খাদ্য সংরক্ষণে: সকল প্রকার শাক-সবজি, ফল সঠিক সংরক্ষণের অভাবে বা রান্নাপ্রক্রিয়া সঠিক না হলে বিভিন্ন ধরনের ক্ষতিকর ব্যাকটেরিয়ার জন্ম হয় যা আমাদের শরীরের জন্য ক্ষতিকর। ক্ষেত্রবিশেষে মৃত্যুর কারণ পর্যন্ত হতে পারে। সাধারণত 60Co থেকে যে গামা রশ্মি নির্গত হয় তা এসব ক্ষতিকর ব্যাকটেরিয়াকে মেরে ফেলে। পােলট্রি ফার্মে এ রশ্মি ব্যবহার করা হয় যখন কোনাে ব্যাকটেরিয়াজনিত রােগের উদ্ভব ঘটে। খাদ্যের গুণগত মান বজায় রেখে খাদ্যকে অনেকদিন সংরক্ষণ করা যায়। সময়মত ও চাহিদা অনুযায়ী খাদ্য সরবরাহ করা যায়।
বিদ্যুৎ উৎপাদনে: কিছু কিছু পরমাণুকে ভেঙে ক্ষুদ্র ক্ষুদ্র পরমাণুতে পরিণত করলে অর্থাৎ ফিশান বিক্রিয়া ঘটালে প্রচুর পরিমাণে তাপশক্তি বের হয়। এই তাপশক্তি ব্যবহার করে জেনারেটর দিয়ে বিদ্যুৎ উৎপন্ন করা হয়। আমরা সেটিকে নিউক্লিয়ার বিদ্যুৎ কেন্দ্র বলি।
তেজস্ক্রিয় আইসােটোপের ক্ষতিকর প্রভাব: তেজস্ক্রিয় আইসােটোপের ক্ষতিকর প্রভাব নিম্নে দেওয়া হলাে :
i. তেজস্ক্রিয় আইসােটোপ থেকে যেন আলফা, বিটা ও গামা রশ্মি নির্গত হয় তা কোষের জিনগত পরিবর্তন ঘটাতে পারে যার ফলাফল হিসেবে ক্যান্সার। রােগের অন্যতম কারণ হিসেবে বিবেচনা করা হয়।
ii. পারমাণবিক অস্ত্র তৈরিতে ব্যবহৃত হয় যা অসংখ্য মানুষের প্রাণহানি ঘটায়।
iii. দ্বিতীয় বিশ্বযুদ্ধে জাপানের হিরােশিমা ও নাগাসাকিতে পারমাণবিক বােমার বিস্ফোরণ ঘটেছিল, তার জন্য কয়েক লক্ষ জীবন ধ্বংস হয়েছে। ১৯৮৬ সালে রাশিয়ার চেরােনােবিলে পারমাণবিক বিদ্যুৎ কেন্দ্রে যে দূর্ঘটনা ঘটেছিল তার ফলে অনেক প্রাণ হারিয়েছে এবং ঐ এলাকায় পরিবেশ দূষণ ঘটেছে।
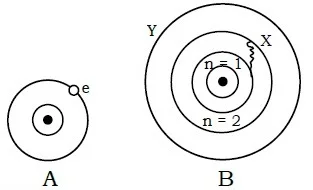
প্রশ্ন : পরমাণুর সৌরমডেল ককে বলে?
উত্তর : পরমাণুর সৌরমডেল : 1911 সালে বিজ্ঞানী রাদারফোর্ড পরমাণুর একটি মডেল প্রদান করেন যা পরমাণুর সৌর মডেল নামে পরিচিত। সৌরজগতের গ্রহগুলির যেমন সূর্যকে কেন্দ্র করে তার চারিদিকে ঘুরছে ঠিক তেমনি পরমাণুর নিউক্লিয়াসকে কেন্দ্র করে ইলেকট্রনগুলি চারিদিকে আবর্তন করছে বলে এ মডেলকে পরমাণুর সৌরমডেল বলা হয়।
পদার্থ বিজ্ঞান প্রথম অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন ৪ পরমাণুর মডেল সম্পর্কে বর্ণনা দাও।
উত্তরঃ পরমাণুর মডেল: ১৯১১ সালে বিজ্ঞানী রাদারফোর্ড ও ১৯১৩ সালে বিজ্ঞানী নীলস বাের পরমাণুর গঠন বর্ণনা করার জন্য পরমাণুর মডেল প্রদান করেন।
রাদারফোর্ডের পরমাণু মডেল : বিজ্ঞানী রাদারফোর্ড ১৯১১ সালে আলফা কণা বিচ্ছুরণ পরীক্ষার সিদ্ধান্তের উপর ভিত্তি করে পরমাণুর গঠনকে একটি ক্ষুদ্র সৌরজগতের সঙ্গে তুলনা করেন। এ কারণে তার প্রস্তাবিত পরমাণু মডেলকে পরমাণুর সৌর মডেলও বলা হয়। এর মূল বক্তব্য হলাে:
১. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মােট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভূত।
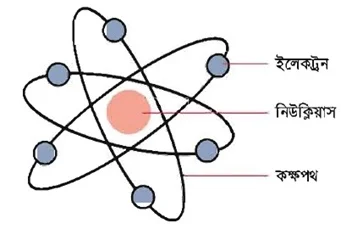
২. পরমাণু বিদ্যুৎ নিরপেক্ষ। কারণ, নিউক্লিয়াসের ধনাত্মক চার্জযুক্ত প্রােটন সংখ্যার সমান সংখ্যক ঋণাত্মক চার্জযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে।
৩. সৌরজগতের সূর্যের চারদিকে ঘূর্ণায়মান গ্রহসমূহের মতাে পরমাণুর ইলেকট্রনগুলাে নিউক্লিয়াসের চারদিকে অবিরাম ঘুরছে। ধনাত্মক চার্জ বিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জ বিশিষ্ট ইলেকট্রনসমূহের মধ্যে পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্ৰবহির্মুখী বল পরস্পর সমান।
বোর–এর পরমাণু মডেল : 1913 সালে নীলস বোর তাঁর বিখ্যাত পরমাণু মডেল প্রকাশ করেন। এ মডেলের স্বীকার্যসমূহ হলো :
১. নিউক্লিয়াসকে কেন্দ্র করে বৃত্তাকার পথে ইলেকট্রনসমূহ ঘুরতে থাকে।
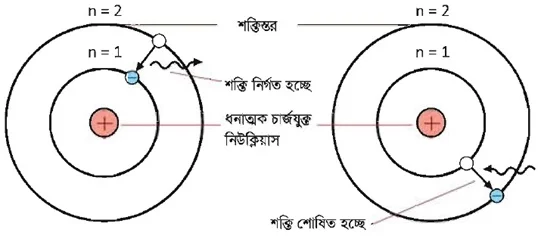
২. নিউক্লিয়াসের চারদিকে বৃত্তাকার কতগুলাে স্থির কক্ষপথ আছে যাতে অবস্থান নিয়ে ইলেকট্রনসমূহ ঘুরতে থাকে। এগুলােকে শক্তিস্তর বা অরবিট বলা হয়। শক্তিস্তরসমূহকে কল্পিত সংখ্যা n-এর মান অনুসারে K, L, M, N দ্বারা প্রকাশ করা হয়। প্রথম শক্তিস্তরকে n = 1 (K শক্তিস্তর), ২য় শক্তিস্তরকে n = 2 (L শক্তিস্তর) এভাবে n-এর মান 3, 4, 5 ইত্যাদি পূর্ণসংখ্যা মানে বৃদ্ধি পেতে থাকে এবং শক্তিস্তরসমূহকে যথাক্রমে M, N, 0 দ্বারা প্রকাশ
করা যায়। একটি নির্দিষ্ট শক্তিস্তরে অবস্থানকালে ইলেকট্রনসমূহ শক্তি শােষণ অথবা বিকিরণ করে না।
৩. যখন কোনাে ইলেকট্রন একটি নিম্নতর কক্ষপথ বা শক্তিস্তর যেমন n = 1 থেকে উচ্চতর কক্ষপথ n =2 তে স্থানান্তরিত হয় তখন নির্দিষ্ট পরিমাণ শক্তি শােষণ করে। আবার, যখন কোনাে উচ্চতর শক্তিস্তর যেমন n = 2 থেকে নিম্নতর কক্ষপথ n = 1-এ স্থানান্তরিত হয় তখন শক্তি বিকিরণ করে।
৪. বাের মডেল অনুসারে কোন শক্তিস্তরে ইলেকট্রনের কৌণিক ভরবেগ, mvr =nh/2p । এখানে, m হচ্ছে ইলেকট্রনের ভর (9.11×10-31kg), r হচ্ছে ইলেকট্রন যে কক্ষপথ বা শক্তিস্তরে ঘুরবে তার ব্যাসার্ধ, v হচ্ছে ইলেকট্রন যে কক্ষপথ বা শক্তিস্তরে ঘুরবে সেই কক্ষপথে ইলেকট্রনের বেগ, h হচ্ছে প্লাংক ধ্রুবক (h = 6.626 x 10-34 kg/s), n হচ্ছে প্রধান শক্তিস্তর বা প্রধান কোয়ান্টাম সংখ্যা (n = 1, 2, 3, …. ইত্যাদি)।
এখানে যে শক্তিস্তরের n এর মান কম সেই শক্তিস্তর নিম্ন শক্তিস্তর এবং যে শক্তিস্তরের n এর মান বেশি সেই শক্তিস্তর উচ্চ শক্তিস্তর হিসেবে পরিচিত।
প্রশ্ন : রাদারফোর্ডের পরমাণু মডেল ও বাের পরমাণু মডেলের সীমাবদ্ধতা উল্লেখ কর।
উত্তর : রাদারফোর্ডের পরমাণু মডেলের সীমাবদ্ধতা:
১. সৌরমন্ডলের গ্রহসমূহ সামগ্রিকভাবে চার্জবিহীন অথচ ইলেকট্রনসমূহ ঋণাত্মক চার্জযুক্ত।
২. ম্যাক্সওয়েলের তত্ত্বানুসারে কোনাে চার্জযুক্ত বস্তু বা কণা কোনাে বৃত্তাকার পথে ঘুরতে থাকলে তা ক্রমাগত শক্তি বিকিরণ করবে এবং তার আবর্তনচক্রও ধীরে ধীরে কমতে থাকবে। সুতরাং ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে প্রবেশ করবে। অর্থাৎ রাদারফোর্ডের পরমাণু মডেল অনুসারে পরমাণু সম্পূর্ণভাবে একটি অস্থায়ী অবস্থা প্রাপ্ত হবে। অথচ পরমাণু হতে ক্রমাগত শক্তি বিকিরণ বা ইলেকট্রনের নিউক্লিয়াসে প্রবেশ কখনই ঘটে না।
৩. পরমাণুর বর্ণালি গঠনের কোনোসুষ্টু ব্যাখ্যা এ মড়েল দিতে পারে না।
৪. আবর্তনশীল ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোনাে ধারণা রাদারফোর্ডের মডেলে দেয়া হয়নি।
৫. একাধিক ইলেকট্রনবিশিষ্ট পরমাণুতে ইলেকট্রনগুলাে নিউক্লিয়াসকে কিভাবে পরিভ্রমণ করে তার কোনাে উল্লেখ এ মডেলে নেই।
বাের পরমাণু মডেলের সীমাবদ্ধতা: বাের পরমাণু মডেলের যেমন অনেক সফলতা রয়েছে তেমনি এর কিছু সীমাবদ্ধতাও আছে। যেমন-
১. বাের পরমাণু মডেল হাইড্রোজেন ও হাইড্রোজেন সদৃশ এক ইলেকট্রনবিশিষ্ট আয়ন বা আয়নসমূহের বর্ণালি ব্যাখ্যা করতে পারলেও একাধিক ইলেকট্রনবিশিষ্ট পরমাণুসমূহের বর্ণালি ব্যাখ্যা করতে পারে না।
২. এক শক্তিস্তর হতে অপর শক্তিস্তরে ইলেকট্রনের স্থানান্তর ঘটলে, বাের পরমাণু মডেল অনুসারে বর্ণালিতে একটি করে রেখা সৃষ্টি হওয়ার কথা। কিন্তু হাইড্রোজেন ও অন্যান্য পরমাণুসমূহের আয়নের রেখা-বর্ণালি অধিকতর সূক্ষ্ম যন্ত্র দ্বারা পরীক্ষণ করলে দেখা যায়, প্রতিটি রেখা কয়েকটি সূক্ষ্ম রেখায় বিভক্ত থাকে।
৩. বােরের পারমাণবিক মডেল অনুসারে পরমাণুতে শুধু বৃত্তাকার কক্ষপথ বিদ্যমান। কিন্তু পরে প্রমাণিত হয়েছে পরমাণুতে ইলেকট্রন শুধু বৃত্তাকার কক্ষপথেই নয় উপবৃত্তাকার কক্ষপথেও ঘুরে।
প্রশ্ন: রাদারফোর্ডের পরমাণু মডেল ও বাের পরমাণু মডেলের তুলনা কর।
উত্তর : পরমাণুর বাের মডেল ও রাদারফোর্ড মডেলের তুলনাঃ
i. রাদারফোর্ড পরমাণু মডেল পরমাণুর গঠন সম্পর্কে প্রথম নির্দেশনা প্রদান করে। আর বাের মডেল রাদারফোর্ড মডেলের উপর প্রতিষ্ঠিত এবং এ মডেল রাদারফোর্ড পরমাণু মডেলের বিভিন্ন সীমাবদ্ধতা দূর করেছে।
ii. নিউক্লিয়াসের বাইরে আবর্তনশীল ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্পর্কে রাদারফোর্ড এর মডেলে কোন ধারণা দেওয়া হয়নি। কিন্তু বাের মডেল রাদারফোর্ড এর এই সীমাবদ্ধতা দূর করে বলেন, ইলেকট্রন সমূহ নির্দিষ্ট শক্তি সম্পন্ন কতগুলাে স্থায়ী বৃত্তাকার পথে কোনরূপ শক্তিক্ষয় না করে অনবরত ঘুরতে থাকে।
iii. রাদারফোর্ড মডেলে বলা হয়েছে পরমাণুতে ইলেকট্রন ও প্রােটন সংখ্যা সমান, এজন্য পরমাণু চার্জ নিরপেক্ষ। এবং প্রােটন ও নিউট্রন একত্রে পরমাণুর কেন্দ্র নিউক্লিয়াসে অবস্থান করে যা বাের মডেলেও স্বীকার করে নেওয়া হয়েছে।
iv. রাদারফোর্ড মডেলে বিভিন্ন শক্তির কক্ষপথে ইলেকট্রনের স্থানাস্তর সম্পর্কে কোন ধারনা দেওয়া হয়নি। কিন্তু বোর মডেলে বলা হয়েছে যে ইলেকট্রনসমূহ সবসময় নিজ শক্তির কক্ষপথে অবস্থান করে। তবে, প্রয়োজনীয় পরিমাণ শক্তি বাইরের উৎস হতে শােষণ করলে ইলেকট্রনসমূহ নিম্ন শক্তির কক্ষপথ হতে লাফ দিয়ে উচ্চ শক্তির স্তরে গমন করে আবার সমপরিমাণ শক্তি বিকিরণ বা ছেড়ে দিয়ে আগের স্তরে ফিরে আসে। এ লাফ দেয়াকে কোয়ান্টাম লম্ফ বলা হয়।
প্রশ্ন : পরমাণুর অধিকাংশ স্থানই ফাঁকা থাকে কেন?
উত্তর : রাদারফোর্ডের α-রশ্মি বিক্ষেপণ পরীক্ষায় অধিকাংশ (প্রায় 99%) α -রশ্মি তাদের গতিপথ থেকে না বেঁকে সােজাসুজি স্বর্ণপাত ভেদ করে চলে যায় এবং ZnS পর্দার উপর উজ্জ্বল ক্ষুদ্র আলােক বিন্দু সৃষ্টি করে। α -রশ্মির ভর ইলেকট্রনের ভরের তুলনায় অনেক গুণ বেশি বলে স্বর্ণপাতের এই স্থানের মধ্য দিয়ে α -রশ্মি অতিক্রম করার সময় কোনােরূপ বাধার সম্মুখীন হয় না। সুতরাং পরমাণুর অধিকাংশ স্থানই ফাকা।
প্রশ্ন : কোয়ান্টাম সংখ্যা কী? বিভিন্নপ্রকার কোয়ান্টাম সংখ্যার নাম লিখ।
উত্তরঃ যে সকল সংখ্যা দ্বারা পরমাণুর মধ্যে কোথায় কিভাবে ইলেকট্রনগুলাে অবস্থান করবে তার সঠিক এবং পূণাঙ্গ বর্ণনা দেওয়া যায় তাদেরকে কোয়ান্টাম সংখ্যা বলে।
শক্তির স্তরে ইলেকট্রন সংখ্যা 2n2 এখানে, n=শেলের সংখ্যা। উপস্তর s = sharp(2), p = principal (6), d = diffused (10),f = fundamental (14). কোয়ান্টাম সংখ্যা চারটি – প্রধান কোয়ান্টাম সংখ্যা, সহকারী কোয়ান্টাম সংখ্যা, ম্যাগনেটিক কোয়ান্টাম সংখ্যা এবং স্পিন কোয়ান্টাম সংখ্যা।
প্রশ্ন : ইলেকট্রন বিন্যাস কী? ইলেকট্রন বিন্যাস করার নিয়ম লিখ।
উত্তর : ইলেক্ট্রন বিন্যাস : একটি পরমাণুতে নিউক্লিয়াসকে কেন্দ্র করে ঘুর্ণায়মান ইলেকট্রনসমূহ তার বিভিন্ন শক্তি স্তরে ও উপস্তরে কিরূপে অবস্থান করে তাকে ইলেকট্রন বিন্যাস বলে। অর্থাৎ কোনাে পরমাণুর বিভিন্ন স্তরে ইলেকট্রন কীভাবে আছে তার প্রকাশকে ইলেকট্রন বিন্যাস বলে।
ইলেকট্রনবিন্যাস করার নিয়ম : পরমাণুতে ইলেকট্রনসমূহের বিন্যাস একটি সুনির্দিষ্ট নিয়ম মেনে চলে। নিয়মটি হল 2n2. বিজ্ঞানী বিউরি এই সূত্রটি প্রদান করেন। যেখানে, n হচ্ছে শক্তিস্তরের সংখ্যা। প্রধান শক্তিস্তরগুলিকে K,L, M, N,O, …..ইত্যাদি।
প্রতিটি শক্তিস্তর আবার কতকগুলাে উপশক্তিস্তরে s, p, d, f এবং আবার প্রত্যেকটি উপশক্তিস্তরে কতগুলাে অরবিটাল থাকে। s- এ 1টি, p-এ 3টি, d-এ 5টি এবং f-এ 7টি অরবিটাল থাকে।
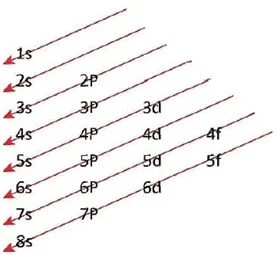
প্রতিটি অরবিটাল সর্বোচ্চ 2টি ইলেকট্রন গ্রহন করতে পারে। উপরের ছক থেকে ইলেকট্রন গ্রহণ ক্ষমতার ক্রমটি নিম্নোক্ত ভাবে লিখতে পারি ।
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p < ৪s
এই নীতি অনুসরণ করে আমরা K(19) এবং Sc(21) এর ইলেকট্রন বিন্যাস দেখাতে পারি-
K(19) ® 1s2 2s2 2p6 3s2 3p6 4s2 এবং Sc(21) ® 1s2 2s2 2p6 3s2 3p6 4s2 3d1 4s2 ।
পদার্থ বিজ্ঞান দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন : পরমাণুর কোন প্রধান শক্তিস্তরে সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতার সূত্রটি লিখ ও উদাহরণসহ ব্যাখ্যা কর।
উত্তর : পরমাণুর কোন প্রধান শক্তিস্তরে সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতার সুত্রটি হলাে : 2n2 এখানে, n = 1, 2, 3, ….ইত্যাদি।
ব্যাখ্যা : বিজ্ঞানী বিউরী 2n2 সুত্রটি প্রদান করেন। এই সূত্র অনুসারে : কোন মৌলের পরমাণুর-
১ম শেলে (শক্তিস্তরে) সর্বোচ্চ ইলেকট্রন থাকতে পরে = 2n2 =2×12 =2×1=2 [ ১ম শেল মানে n =1]
২য় শেলে (শক্তিস্তরে) সর্বোচ্চ ইলেকট্রন থাকতে পরে = 2n2 =2×22 =2×4= ৪
৩য় শেলে (শক্তিস্তরে) সর্বোচ্চ ইলেকট্রন থাকতে পরে = 2n2 =2×32 =2×9 =18
৪র্থ শেলে (শক্তিস্তরে) সর্বোচ্চ ইলেকট্রন থাকতে পরে = 2n2 =2×42 =2×16 = 32
…………………………………………………………………………………….
পরমাণুতে ইলেকট্রন বিন্যাসের আধুনিক নিয়ম : পরমাণুতে নিউক্লিয়াসের চারদিকে কতগুলাে কক্ষপথ বা শক্তিস্তর বা শেল থাকে, যাদের অরবিট বলা হয়। এদের নাম K, L, M, N, O, P ও Q ইত্যাদি।
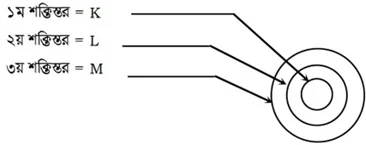
K, L, M, N ইত্যাদি শক্তিস্তর আবার কতগুলাে অরবিটাল বা উপশক্তিস্তরে বিভক্ত থাকে। যেমন :
K শক্তিস্তরে বা ১ম শক্তিস্তরে 1টি উপশক্তিস্তর থাকে যার নাম 1s
L শক্তিস্তরে বা ২য় শক্তিস্তরে 2টি উপশক্তিস্তর থাকে যাদের নাম 2s, 2p
M শক্তিস্তরে বা ৩য় শক্তিস্তরে 3টি উপশক্তিস্তর থাকে যাদের নাম 3s, 3p, 3d
N বা ৪র্থ শক্তি স্তর থেকে শুরু করে উচ্চ শক্তিস্তর প্রত্যেকটিতে 4টি করে উপশক্তিস্তর থাকে, যাদের নাম 4s, 4p, 4d, 4f অর্থাৎ, s উপশক্তিস্তরে অরবিটাল 1টি, p উপশক্তিস্তরে অরবিটাল 3টি, d উপশক্তিস্তরে অরবিটাল 5টি, f উপশক্তিস্তরে অরবিটাল 7টি।
প্রতিটি অরবিটালে সর্বোচ্চ 2টি ইলেকট্রন থাকতে পারে আবার 1টিও থাকতে পারে, নাও থাকতে পারে। প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা 2n2, যেখানে, n = 1, 2, 3, 4… ইত্যাদি। 2n2 সূত্রানুসারে-
K শেলের ইলেকট্রন ধারণক্ষমতা, 2 x 12 = 2টি
L শেলের ইলেকট্রন ধারণক্ষমতা, 2 x 22 = 8টি
M শেলের ইলেকট্রন ধারণক্ষমতা, 2 x 32 = 18টি
N শেলের ইলেকট্রন ধারণক্ষমতা, 2x 42 = 32টি ইত্যাদি।
পরমাণুর ইলেকট্রন বিন্যাসের সময় ইলেকট্রনসমূহ বিভিন্ন অরবিটালে (উপশক্তিস্তরে) তাদের শক্তির নিম্নক্রম থেকে উচ্চতম অনুসারে প্রবেশ করে। স্থিতিশীলতা অর্জনের জন্য প্রথমে নিম্নশক্তি অরবিটালে ইলেকট্রন গমন করে এবং অরবিটাল পূর্ণ করে; এরপর ক্রমান্বয়ে উচ্চশক্তির অরবিটাল ইলেকট্রনদ্বারা পূর্ণ হয়। অরবিটালসমূহের শক্তিক্রম নিম্নরূপ :
1s→ 2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p→8s।
এই নিয়মটি একটি ছকের মাধ্যমে দেখানাে হলাে :
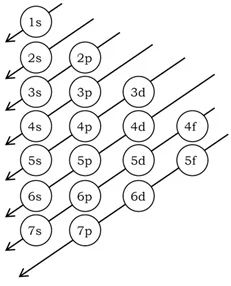
চিত্র : পরমাণুর বিভিন্ন শক্তিস্তরে ইলেকট্রন গমনের নিয়ম
তবে, এই নিয়মের ব্যতিক্রমও আছে। অধিকাংশ ক্ষেত্রেই দেখা যায় যে, s, p, d, f অরবিটালগুলো অর্ধপূর্ণ বা পূর্ণরূপে ইলেকট্রনপেলে তারা অধিকতর স্থায়ী গঠন অর্জন করে।
সুতরাং d10s1, d5s1 ধরনের ইলেকট্রন বিন্যাস অধিকতর স্থায়ী।
প্রশ্ন : ফিশান ও ফিউশন বলতে কী বুঝ?
উত্তর : ফিশান : যে বিক্রিয়ায় কোন ভারী নিউক্লিয়াসকে উচ্চ গতিশক্তি সম্পন্ন কোন কণাদ্বারা আঘাত করলে কাছাকাছি ভরের নতুন একাধিক নিউক্লিয়াস উৎপন্ন হয় তাকে নিউক্লিয়ার ফিশান বা নিউক্লিয়ার বিভাজন বলে। প্রধান শর্ত হচ্ছে, ভারী নিউক্লিয়াসকে অবশ্যই নিউট্রন কণা দ্বারা আঘাত করতে হবে। যেমন-

এ বিক্রিয়াটি ঘটিয়ে পারমাণবিক বোমার বিস্ফোরণ ঘটানো হয়।
ফিউশন : যে নিউক্লিয়ার বিক্রিয়ায় উচ্চ শক্তির প্রভাবে ক্ষুদ্র দুটি নিউক্লিয়াস যুক্ত হয়ে একটি অপেক্ষাকৃত বড় নিউক্লিয়াস উৎপন্ন করে এবং সাথ বিপুল পরিমাণ শক্তি উদ্ভব ঘটে তাকে নিউক্লিয়ার ফিউশন বা নিউক্লিয়ার সংযোজন বিক্রিয়া বলে।
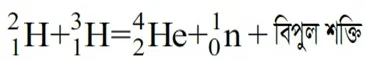
এ নিউক্লিয়ার ফিউশন বিক্রিয়ার উপর ভিত্তি করে হাইড্রোজেন বোমা তৈরী করা হয়েছে।
প্রশ্ন : নিউক্লিয় ফিশান ও ফিউশনের মধ্যে পার্থক্য লিখ।
উত্তর : নিম্নে নিউক্লিয় ফিশান ও নিউক্লিয় ফিউশানের মধ্যে পার্থক্য দেওয়া হলো:
| নিউক্লিয়ার ফিশান | নিউক্লিয় ফিউশান | |
| ১. | ফিশান বিক্রিয়ায় একটি অতি বৃহৎ নিউক্লিয়াস দুটি প্রায় কাছাকাছি ভর বিশিষ্ট নিউক্লিয়াসে বিভক্ত হয়। | ফিউশন বিক্রিয়ায় দুটি ক্ষুদ্র নিউক্লিয়াস একত্রিত হয়ে অপেক্ষাকৃত বড় নিউক্লিয়াস গঠন করে। |
| ২. | নিউক্লিয় ফিশান বিক্রিয়া হল চেইন বা শিকল বিক্রিয়া, যা অনবরত চলতে থাকে। | নিউক্লিয় ফিউশন বিক্রিয়া চেইন বিক্রিয়া নয়। |
| ৩. | বৃহৎ নিউক্লিয়াসকে নিউট্রন দ্বারা আঘাত করে বিক্রিয়া সূচনা ঘটানো হয়। | অত্যাধিক উচ্চ তাপমাত্রায় ক্ষুদ্র ক্ষুদ্র নিউক্লিয়াসকে উত্তপ্ত করে ফিউশন বিক্রিয়া ঘটানো হয়। |
| ৪. | ফিশান বিক্রিয়ায় বিপুল তাপ শক্তি নির্গত হয়। | ফিশান বিক্রিয়ার তুলনায় নিউক্লিয় ফিউশনে অনেক বেশি তাপ শক্তি নির্গত হয়। |
| ৫. | পারমাণবিক চুল্লীতে ফিশান বিক্রিয়াকে নিয়ন্ত্রিত করে বিদ্যুৎ শক্তি উৎপাদন করা সম্ভব। | নিউক্লিয় ফিউশন বিক্রিয়া নিয়ন্ত্রণ করা সম্ভব হয়নি। |
| ৬. | প্রচুর নিউক্লিয় বর্জ্য পদার্থ অবশেষ থাকে। | কোন নিউক্লিয় বর্জ্য পদার্থ অবশেষ থাকে না। |
প্রশ্ন : নিউক্লিয়ার বিক্রিয়া কী?
উত্তর : কোন উচ্চ শক্তিসম্পন্ন কণা বা ক্ষুদ্র নিউক্লিয়াস দ্বারা দ্রুত গতিতে অপর কোন নিউক্লিয়াসকে আঘাত করলে সংশ্লিষ্ট নিউক্লিয়াসের পরিবর্তনের মাধ্যমে যে নতুন নিউক্লিয়াস বিশিষ্ট পরমাণুর উদ্ভব ঘটে, তাকে নিউক্লিয়ার বিক্রিয়া বলে। সর্বপ্রথম 1919 সালে রাদারফোর্ড আলফা কণা দ্বারা নাইট্রেজেন পরমাণুর নিউক্লিয়াসকে আঘাত করে অক্সিজেন ও প্রোটন উৎপন্ন করেন। সংঘটিত বিক্রিয়াটি নিম্নরূপ:
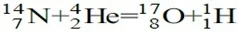
নিউক্লিয় বিক্রিয়ায় নিউক্লিয়াসের পরিবর্তন হলেও সর্বমোট প্রোটন ও নিউট্রন সংখ্যার কোন পরিবর্তন হয় না। |
প্রশ্ন : অরবিট ও অরবিটাল বলতে কী বুঝ?
উত্তর : অরবিট : পরমাণুতে নিউক্লিয়াসে চতুর্দিকে ইলেকট্রন আবর্তনের জন্য কতকগুলো নির্দিষ্ট শক্তি সম্পন্ন কক্ষপথ রয়েছে যাদের প্রত্যেকটিকে এক একটি শক্তিস্তর বলা হয়। এই প্রধান শক্তিস্তরই অরবিট নামে পরিচিত। অর্থাৎ কোন পরমাণুর নিউক্লিয়াসের চতুর্দিকে যে নির্দিষ্ট বৃত্তাকার পথে ইলেকট্রনগুলো আবর্তনশীল থাকে তাকে অরবিট বলে। অরবিটে ইলেকট্রনের শক্তি ভিন্ন ভিন্ন হয়। নিউক্লিয়াস থেকে যত দূরে শক্তিস্তর বা অরবিট অবস্থান করে অরবিটের আকার তত বৃদ্ধি পায়। নিউক্লিয়াসের কাছের শক্তিস্তর K শেল বা প্রথম অরবিট ।
রসায়ন দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
অরবিটাল : কোন পরমাণু নিউক্লিয়াসের চতুর্দিকে নির্দিষ্ট যে বিশেষ ত্রিমাত্রিক অঞ্চলে ইলেকট্রনের প্রাপ্তির সর্বোচ্চ সম্ভাব্যতা থাকে তাকে অরবিটাল বা পরমাণবিক অরবিটাল বলে। অরবিটাল s, p, d, f ইত্যাদি শ্রেণিতে বিভক্ত করা হয়।
প্রশ্ন : অরবিট ও অরবিটালের মধ্যে পার্থক্য লিখ।
উত্তর : অরবিট ও অরবিটালের মধ্যে পার্থক্য নিম্নেদেওয়া হলো :
| অরবিট | অরবিটাল | |
| ১. | পরমাণুতে নিউক্লিয়াসের চতুর্দিকে যে সকল নির্দিষ্ট শক্তিস্তরে বা প্রধান কক্ষপথে ইলেকট্রন আবর্তন করে তাকে অরবিট বলে। | নিউক্লিয়াসের চারদিকে যে নির্দিষ্ট ত্রিমাত্রিক স্থানে কোন নির্দিষ্ট শক্তির ইলেকট্রনের অবস্থানের সম্ভাবনা বেশী থাকে তাকে অরবিটাল বলে। |
| ২. | অরবিট দ্বারা নিউক্লিয়াসের চারদিকে দ্বি-মাত্রিক বৃত্তাকার পথে ইলেকট্রনের আবর্তন বােঝায়। | অরবিটাল দ্বারা নিউক্লিয়াসের চতুর্দিকে ত্রিমাত্রিক স্থানে ইলেকট্রন আবর্তন বোঝায়। |
| ৩. | অরবিটসমূহ বৃত্তাকার। | বিভিন্ন অরবিটালের আকৃতি বিভিন্ন, যেমন s অরবিটাল বর্তুলাকার, p অরবিটাল ডাম্বেল আকৃতির। |
| ৪. | অরবিটসমূহ প্রধান কোয়ান্টাম সংখ্যা n এর সাথে সম্পর্কিত। | অবিটালসমূহ কোয়ান্টাম সংখ্যা 1 এবং সহকারী কোয়ান্টাম সংখ্যা l এর সাথে সম্পর্কিত। |
| ৫. | অরবিটসমূহকে n দ্বারা চিহ্নিত করা হয়, n =1 হলে, K অরবিট, n = 2 হলে L অরবিট। | অরবিটালসমূহকে s, p, d, f দ্বারা চিহ্নিত করা হয়। |
| ৬. | প্রতিটি অরবিটে সর্বোচ্চ 2n2 সংখ্যক ইলেকট্রন থাকতে পারে, এখানে n=1, 2, 3,…….। যেমন-১ম অরবিটে ইলেকট্রন সংখ্যা 2টি, ২য় অরবিটে ইলেকট্রন সংখ্যা 3টি। | প্রতিটি অরবিটালে সর্বোচ্চ দুটি বিপরীত স্পিনের ইলেকট্রন থাকতে পারে। |
| ৭. | ইলেকট্রনগুলোকে কণারূপে বিবেচনা করে অরবিটের অবতরণা করা হয়। | ইলেকট্রনগুলোকে মেঘরূপে বিবেচনা করে অরবিটালোর অবতারণা করা হয়। |
প্রশ্ন : ক্রোমিয়াম এর ইলেকট্রন বিন্যাসে সাধারণ নিয়মের ব্যতিক্রম দেখা যায় কেন?
উত্তর : ক্রোমিয়ামের ইলেকট্রন বিন্যাস নিম্নরূপ:
Cr(24) → 1s2 2s2 2p6 3s2 3p6 3d5 4s1 ।
আমরা জানি, কোন অরবিটাল ইলেকট্রন দ্বারা অর্ধপূর্ণ বা পূর্ণ থাকলে উহা অধিকতর স্থিতিশীল হয়। ক্রোমিয়ামের ইলেকট্রন বিন্যাস থেকে লক্ষ্য করা যায় যে, উহার d অরবিটালে 4টি ইলেকট্রন বিদ্যমান কিন্তু d অরবিটাল অর্ধপূর্ণ অর্থাৎ স্থিতিশীলতা অর্জনের জন্য বহিঃস্থ 4s অরবিটাল থেকে একটি ইলেকট্রন গ্রহণ করে d5 অর্জন করে তখন d4 অপেক্ষা d5 এর স্থিতিশীলতা বেশী হয়। এ কারণে ক্রোমিয়ামের ইলেকট্রন বিন্যাসে সাধারণ নিয়মের ব্যতিক্রম দেখা যায়।
প্রশ্ন : পটাশিয়ামের 19 তম ইলেকট্রনটি 3d উপস্তরে না গিয়ে 4s উপস্তরে যায় কেন?
উত্তর : পরমাণুতে ইলেকট্রন বিন্যাস আউফবাউ নীতি অনুসারে নির্দিষ্ট হয়, নীতিটি নিম্নরূপ-ইলেকট্রনসমূহ বিভিন্ন অরবিটালে শক্তির উচ্চ ক্রমানুসারে প্রবেশ করে। অর্থাৎ ইলেকট্রন প্রথমে নিম্নশক্তির অরবিটালে এবং পরে ক্রমান্বয়ে উচ্চ শক্তির অরবিটালে স্থান গ্রহণ করে। কারণ নিম্ন শক্তির স্তরে স্থিতিশীলতা বেশি। দুটি অরবিটালের মধ্যে কোনটি নিম্ন শক্তির তা প্রধান কোয়ান্টাম সংখ্যা n এবং সহকারী কোয়ান্টাম সংখ্যা l এর মান থেকে হিসেব করা হয়। যে অরবিটালের জন্য (n + l) এর মান কম সেটিই নিম্ন শক্তির অরবিটাল এবং ইলেকট্রন সেখানেই প্রথম প্রবেশ করে।
3d অরবিটালের জন্য n =3, l =2 .:. n+ l = 3 + 2 = 5 [spdf = 2(2l +1) এবং l = 0, 1, 2, 3]
4s অরবিটালের জন্য n = 4, l = 0 .:. n+ l = 4 + 0 = 0
সুতরাং 3d এর চেয়ে 4s এর শক্তি কম বলে পটাসিয়ামের 19 তম ইলেকট্রনটি 3d অরবিটালে না গিয়ে 4s অরবিটালে যায়।
K(19) এর ইলেকট্রন বিন্যাস →1s2 2s2 2p6 3s2 3p6 4s1 ।
প্রশ্ন : পরমাণুর দ্বিতীয় শক্তিস্তরে d – অরবিটাল থাকে না কেন?
উত্তর : দ্বিতীয় শক্তিস্তরের জন্য প্রধান কোয়ান্টাম সংখ্যা n = 2। যখন n = 2 হয় তখন l এর মান 0, 1 হয়। অর্থাৎ পরমাণুর ২য় শক্তিস্তরে s, p উপস্তর বিদ্যমান। সুতরাং পরমাণুর ২য় শক্তিস্তরে 2s ও 2p অরবিটাল সম্ভব কিন্তু 2d অরবিটাল সম্ভব নয়। কারণ d উপস্তরের জন্য l এর মান 2 হওয়া প্রয়োজন, যা ২য় শক্তিস্তরে মোটেও সম্ভব নয়। এ কারণে পরমাণুর ২য় শক্তিস্তরে d – অরবিটাল থাকে না।
জ্ঞানমূলক প্রশ্ন ও উত্তর
প্রশ্ন ॥ ১ ॥ নিউক্লিয়াসের চতুর্দিকে ঘূর্ণায়মান কণিকার নাম কী?
উত্তর : নিউক্লিয়াসের চতুর্দিকে ঘূর্ণায়মান কণিকার নাম ইলেকট্রন।
প্রশ্ন ॥ ২॥ মৌলিক কণিকা কাকে বলে?
উত্তর : যেসব অতি সূক্ষ্ম কণিকা দ্বারা পরমাণু গঠিত, তাদের মৌলিক কণিকা বলা হয়। এগুলাে হলাে ইলেকট্রন, প্রােটন ও নিউট্রন।
প্রশ্ন ॥ ৩॥ পরমাণুর নিউক্লিয়াস কী কী কণিকা দ্বারা গঠিত?
উত্তর : পরমাণুর নিউক্লিয়াস প্রােটন ও নিউট্রন নামক কণিকা দ্বারা গঠিত।
প্রশ্ন ॥ ৪ ॥ ইলেকট্রন পরমাণুর মধ্যে কোথায় অবস্থান করে?
উত্তর : ইলেকট্রন পরমাণুর মধ্যে নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষে বা শক্তিস্তরে অবস্থান করে।
প্রশ্ন ॥ ৫ ॥ নিউট্রনবিহীন একটি পরমাণুর নাম কর।
উত্তর : নিউট্রনবিহীন একটি পরমাণুর নাম হাইড্রোজেন।
প্রশ্ন ॥ ৬ ॥ মৌলের পরমাণু কয়টি মূল উপাদান দ্বারা গঠিত?
উত্তর : মৌলের পরমাণু ৩টি মূল উপাদান দ্বারা গঠিত।
প্রশ্ন ॥ ৭ ॥ প্রােটনের তড়িৎ আধানের প্রকৃতি কী?
উত্তর : প্রােটনের তড়িৎ আধানের প্রকৃতি হলাে ধনাত্মক।
প্রশ্ন ॥ ৮ ॥ পদার্থের ক্ষুদ্রতম অবিভাজ্য কণাকে কী বলে?
উত্তর : পদার্থের ক্ষুদ্রতম অবিভাজ্য কণাকে পরমাণু বলে।
প্রশ্ন ॥ ৯ ॥ হাইড্রোজেন মৌলের আইসােটোপ কয়টি?
উত্তর: হাইড্রোজেন মৌলের আইসােটোপ তিনটি।
প্রশ্ন ॥ ১০ ॥ তেজস্ক্রিয় পদার্থ থেকে কী নির্গত হয়?
উত্তর : তেজস্ক্রিয় পদার্থ থেকে অনবরত স্বতঃস্ফূর্তভাবে তেজস্ক্রিয় রশ্মি নির্গত হয়।
প্রশ্ন ॥ ১১ ॥ তেজস্ক্রিয় পদার্থ থেকে কয়টি তেজস্ক্রিয় রশ্মি নির্গত হয়?
উত্তর : তেজস্ক্রিয় পদার্থ থেকে তিনটি তেজস্ক্রিয় রশ্মি নির্গত হয়।
প্রশ্ন ॥ ১২ ॥ পারমাণবিক সংখ্যা কম এমন একটি মৌলের তেজস্ক্রিয় আইসােটোপ উল্লেখ কর।
উত্তর : পারমাণবিক সংখ্যা কম এমন একটি মৌলের তেজস্ক্রিয় আইসােটোপ হলাে 3215P।
প্রশ্ন ॥ ১৩ ॥ কোন ভূতাত্ত্বিক বৈজ্ঞানিক গবেষণার কাজে আইসােটোপ ব্যবহৃত হয়?
উত্তর : কোটি কোটি বছর আগের পুরনাে ফসিলের বয়স গণনায় আইসােটোপ ব্যবহৃত হয়।
প্রশ্ন ॥ ১৪ ॥ P পরমাণুর সবচেয়ে বাইরের কক্ষে কয়টি ইলেকট্রন আছে?
উত্তর : P পরমাণুর সবচেয়ে বাইরের কক্ষে 5টি ইলেকট্রন আছে।
প্রশ্ন ॥ ১৫ ॥ পরমাণুর তৃতীয় শক্তিস্তরে সর্বোচ্চ কতটি ইলেকট্রন থাকতে পারে?
উত্তর : পরমাণুর তৃতীয় শক্তিস্তরে সর্বোচ্চ 18টি ইলেকট্রন থাকতে পারে।
প্রশ্ন ॥ ১৬ ॥ একটি পরমাণুর আধানের প্রকৃতি কীরূপ?
উত্তর : একটি পরমাণু আধান নিরপেক্ষ।
প্রশ্ন ॥ ১৭ ॥ পরমাণুর নিজস্ব সত্ত্বা কী?
উত্তর : পরমাণুর প্রােটন সংখ্যাকে বলা হয় পারমাণবিক সংখ্যা যা একটি পরমাণুর নিজস্ব সত্তা বা তার পরিচয়।
প্রশ্ন ॥ ১৮ ॥ অস্থিত আইসােটোপগুলাে কী বিকিরণ করে?
উত্তর : অস্থিত আইসােটোপগুলাে বিভিন্ন ধরনের রশ্মি (যেমন- α-আলফা, B- বিটা, γ-গামা) বিকিরণ করে।
প্রশ্ন ॥ ১৯ ॥ বর্ণালি কী?
উত্তর : বর্ণালি হলাে বিভিন্ন বর্ণের আলাের সমাবেশ।
প্রশ্ন ॥ ২০ ॥ f উপস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা কত?
উত্তর : f-উপস্থরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা 14টি।
প্রশ্ন ॥ ২১ ॥ স্ক্যান্ডিয়ামের সর্বশেষ ইলেকট্রনটি কোন অরবিটালে প্রবেশ করে?
উত্তর : স্ক্যান্ডিয়ামের সর্বশেষ ইলেকট্রনটি 3d-অরবিটালে প্রবেশ করে।
জীববিজ্ঞান সাজেশন পেতে এখানে ক্লিক করুন
প্রশ্ন ॥ ২২ ॥ ইলেকট্রনসূহের সাধারণ ধর্ম কী?
উত্তর : ইলেকট্রনসমূহের সাধারণ ধর্ম হচ্ছে এরা প্রথমে নিম শক্তিসম্পন্ন উপস্তর পূর্ণ করে এবং ক্রমান্বয়ে উচ্চ শক্তিসম্পন্ন উপস্তরে গমন করে।
প্রশ্ন ॥ ২৩ ॥ প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা | কোন সুত্র মেনে চলে?
উত্তর : প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা 2n2 সূত্র মেনে চলে।
প্রশ্ন ॥ ২৪ ॥ ক্যান্সার নিরাময়ে কোনটি দেওয়া হয়?
উত্তর : ক্যান্সার নিরাময়ে কেমােথেরাপি দেওয়া হয়।
প্রশ্ন ॥ ২৫ ॥ গাইগার কাউন্টার কী?
উত্তর : যে যন্ত্রের সাহায্যে তেজস্ক্রিয় মৌল থেকে তেজস্ক্রিয় রশ্মি বা কণা শনাক্ত করা হয়, তাকে গাইগার কাউন্টার বলে।
অনুধাবনমূলক প্রশ্ন ও উত্তর
প্রশ্ন ॥ ১ ॥ একটি পরমাণুতে কোথায় কোথায় ইলেকট্রন, প্রােটন ও নিউট্রন থাকে তা চিত্র এঁকে দেখাও।
উত্তর : একটি পরমাণুতে ইলেকট্রন, প্রােটন ও নিউট্রন কীভাবে বিন্যস্ত থাকে | তা নিচে দেখানাে হলাে :
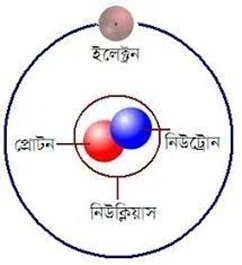
চিত্র : একটি পরমাণুর গঠন।
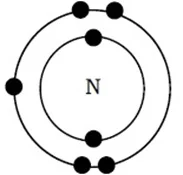
প্রশ্ন ॥ ২॥ নাইট্রোজেনের পারমাণবিক সংখ্যা 7। একটি নাইট্রোজেন পরমাণুর ইলেকট্রন বিন্যাস এঁকে দেখাও।
উত্তর : নাইট্রোজেনের পারমাণবিক সংখ্যা 7। এর ইলেকট্রন বিন্যাস 2, 5। নাইট্রোজেন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ :
প্রশ্ন ॥ ৩ ॥ পরমাণুর কোন কোন অংশে প্রােটন, নিউট্রন এবং ইলেকট্রন থাকে?
উত্তর : পরমাণুর নিউক্লিয়াসে থাকে প্রােটন ও নিউট্রন। আর ইলেকট্রন নিউক্লিয়াসের বাইরে চারদিকে ঘুরতে থাকে। ইলেকট্রন ঋণাত্মক চার্জযুক্ত, প্রােটন ধনাত্মক ও নিউট্রন চার্জ নিরপেক্ষ কণা। স্বাভাবিক অবস্থায় প্রত্যেক পরমাণুতে সমান সংখ্যক ইলেকট্রন ও প্রােটন থাকায় পরমাণু চার্জ নিরপেক্ষ হয়।
প্রশ্ন ॥ ৪ ॥ পরমাণু কি অবিভাজ্য?
উত্তর : রাসায়নিক বিক্রিয়ায় পরমাণুসমূহ অবিভাজ্য হিসেবেই থাকে অর্থাৎ পরমাণুকে ভাঙা যায় না। তবে বর্তমানে বিশেষ উপায়ে পরমাণুকে ভেঙে ইলেকট্রন, প্রােটন, নিউট্রনসহ আরও কয়েকটি মৌলিক কণা পাওয়া গেছে।
প্রশ্ন ॥ ৫॥ পারমাণবিক সংখ্যাকে মৌলের পরিচয় বলা হয় কেন?
উত্তর : পারমাণবিক সংখ্যা হলাে, একটি নির্দিষ্ট সংখ্যা যা ঐ মৌলের পরমাণুতে বিদ্যমান প্রােটনের সংখ্যা। এটি ঐ মৌলের নিজস্ব ও স্বতন্ত্র ধর্ম যা অন্য কোনাে মৌলের থাকে না বলেই একে মৌলের পরিচয় বলা হয়। মৌলের পারমাণবিক সংখ্যা পরিবর্তিত হলে মৌলের মূল ধর্মের পরিবর্তন হয়। ফলে ওই মৌলের পরমাণু নতুন ধর্মবিশিষ্ট অন্য একটি মৌলের পরমাণুতে পরিণত হয়। অর্থাৎ দুটি বিভিন্ন মৌলের পারমাণবিক সংখ্যা কখনাে সমান হয় না। এজন্য পারমাণবিক সংখ্যাকে মৌলের পরিচয় বলা হয় ।
প্রশ্ন ॥ ৬ ॥ ভরসংখ্যা সব সময় একটি পূর্ণ সংখ্যা হয় কেন?
উত্তর : আমরা জানি, ভরসংখ্যা = প্রােটন সংখ্যা + নিউট্রন সংখ্যা। পরমাণুর নিউক্লিয়াসের মধ্যস্থ প্রােটন এবং নিউট্রন অবিভাজ্য। কাজেই পরমাণুর মধ্যে প্রােটন ও নিউট্রনের সমষ্টি কখনাে ভগ্নাংশ হতে পারে না। এরা সব সময় পূর্ণ সংখ্যায় নিউক্লিয়াসে বর্তমান থাকে। একটি প্রােটনের ভরসংখ্যা 1 এবং একটি নিউট্রনের ভর একটি প্রােটনের ভরের প্রায় সমান। এ কারণে ভর সংখ্যা কখনাে ভগ্নাংশ হয় না – সর্বদা পূর্ণসংখ্যা হয়।
প্রশ্ন ॥ ৭ ॥ পরমাণুতে আইসােটোপের উৎপত্তি হয় কেন?
উত্তর : কোনাে মৌলের বিভিন্ন পরমাণুর নিউক্লিয়াসে একই সংখ্যক প্রােটনের সঙ্গে ভিন্ন ভিন্ন সংখ্যক নিউট্রন থাকার জন্য পরমাণুগুলাের ভর বিভিন্ন হয়। ফলে আইসােটোপের উৎপত্তি হয়। মৌলের আইসােটোপগুলােতে পারমাণবিক সংখ্যা অর্থাৎ প্রােটন সংখ্যা একই কিন্তু ভর সংখ্যা বিভিন্ন হয়।
প্রশ্ন ॥ ৮ ॥ ভর সংখ্যা এবং পারমাণবিক সংখ্যার মধ্যে সম্পর্ক স্থাপন কর।
উত্তর : আমরা জানি, ভরসংখ্যা = প্রােটন সংখ্যা + নিউট্রন সংখ্যা যেহেতু, প্রােটন সংখ্যা = পারমাণবিক সংখ্যা সুতরাং ভরসংখ্যা = পারমাণবিক সংখ্যা + নিউট্রন সংখ্যা
অতএব, পারমাণবিক সংখ্যা = ভরসংখ্যা – নিউট্রন সংখ্যা
এটাই ভর সংখ্যা এবং পারমাণবিক সংখ্যার মধ্যে সম্পর্ক।
প্রশ্ন ॥ ৯ ॥ একটি পরমাণুর K কক্ষে 2টি, L কক্ষে ৪টি এবং M কক্ষে একটি ইলেকট্রন আছে। পরমাণুটির পারমাণবিক সংখ্যা কত?
উত্তর : পরমাণুরতে মােট ইলেকট্রন সংখ্যা = 2+8+1 = 11
.:. মােট প্রােটন সংখ্যা = 11 এবং পারমাণবিক সংখ্যা = 11
প্রশ্ন ॥ ১০ ॥ কোন কোন ইলেকট্রন বিন্যাস বিশিষ্ট মৌল অধিকতর স্থায়ী হয়?
উত্তর : সাধারণভাবে দেখা যায় যে, সমশক্তিসম্পন্ন অরবিটালসমূহ অর্ধপূর্ণ বা সম্পূর্ণরূপে পূর্ণ হলে সে ইলেকট্রন বিন্যাস অধিকতর সুস্থিতি অর্জন করে। সুতরাং, np3, np6, ns1, ns2, nd5, nd10, nf7 এবং nfl4 সবচেয়ে সুস্থিত হয়। যার দরুণ d10s1 এবং d5s1 ইলেকট্রন বিন্যাসবিশিষ্ট মৌল অধিকতর স্থায়ী হয়।
প্রশ্ন ॥ ১১ ॥ তেজস্ক্রিয় আইসােটোপের বহুমুখী ব্যবহার লিখ।
উত্তর : তেজস্ক্রিয় আইসােটোপ কীটপতঙ্গ নিয়ন্ত্রণে, শিল্পক্ষেত্রে, ধাতব পাত্রের পুরুত্ব পরিমাপে, বদ্ধপাত্রে তরলের উচ্চতা পরিমাপে, পাইপ লাইনের ছিদ্র অন্বেষণে প্রভৃতি কাজে ব্যবহার করা হয়। এছাড়া, ফসিল মমিসহ পৃথিবীর যাবতীয় বস্তুর বয়স, এমনকি পৃথিবীর বয়স নির্ধারণে তেজস্ক্রিয় আইসােটোপ (14C) ব্যবহৃত হয়।
প্রশ্ন ॥ ১২ ॥ কার্বনের পারমাণবিক সংখ্যা ও ভরসংখ্যা যথাক্রমে 6 এবং 12 হলে কার্বন পরমাণুর গঠন সম্পর্কে আলােচনা কর।
উত্তর : পারমাণবিক সংখ্যা = প্রােটন সংখ্যা = ইলেকট্রন সংখ্যা। যেহেতু কার্বনের পারমাণবিক সংখ্যা = 6, সুতরাং কার্বন পরমাণুতে প্রােটন সংখ্যা = 6, ইলেকট্রন সংখ্যা 6। আবার নিউট্রন সংখ্যা = ভরসংখ্যা – পারমাণবিক সংখ্যা = 12 – 6 = 6। যেহেতু পরমাণুর নিউক্লিয়াসে প্রােটন এবং নিউট্রন থাকে। সুতরাং কার্বন পরমাণুর নিউক্লিয়াসে 6টি প্রােটন এবং 6টি নিউট্রন থাকে। আবার কার্বন পরমাণুর মধ্যে 6টি ইলেকট্রন বর্তমান, কাজেই এ 6টি ইলেকট্রন নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষে আবর্তন করে।
প্রশ্ন ॥ ১৩ ॥ কোনাে মৌলের একটি পরমাণুতে 11 টি প্রােটন এবং 12 টি নিউট্রন আছে। মৌলটির ভরসংখ্যা, পারমাণবিক সংখ্যা এবং ইলেকট্রন সংখ্যা নির্ণয় কর।
উত্তর : পরমাণুর ভরসংখ্যা = প্রােটন সংখ্যা + নিউট্রন সংখ্যা = 11 + 12 = 23, আবার পারমাণবিক সংখ্যা = প্রােটন সংখ্যা = ইলেকট্রন সংখ্যা। যেহেতু প্রােটন সংখ্যা = 11, সুতরাং পারমাণবিক সংখ্যা = 11, ইলেকট্রন সংখ্যা = 11।
প্রশ্ন ॥ ১৪ ॥ একটি মৌলের ভরসংখ্যা 27 এবং পারমাণবিক সংখ্যা 13। এর নিউক্লিয়াসে কয়টি প্রােটন ও কয়টি নিউট্রন আছে?
উত্তর : আমরা জানি, ভরসংখ্যা = প্রােটন সংখ্যা + নিউট্রন সংখ্যা।
আবার,
পারমাণবিক সংখ্যা = প্রােটন সংখ্যা।
.:. প্রােটন সংখ্যা = 13 এবং নিউট্রন সংখ্যা = ভরসংখ্যা – প্রােটন সংখ্যা = 27 – 13 = 14।
সুতরাং, মৌলটির নিউক্লিয়াসে 13টি প্রােটন ও 14টি নিউট্রন আছে।
প্রশ্ন ॥ ১৫ ॥ 32P আইসােটোপ কী বিশেষ কাজে ব্যবহার করা হয়?
উত্তর : 32P আইসােটোপ কৃষিক্ষেত্রে পতঙ্গ নিয়ন্ত্রণে ব্যবহার করা হয়। এছাড়া কখন, কোন সার, কী পরিমাণ ব্যবহার করতে হবে তা জানতেও এই আইসােটোপ ব্যবহার করা হয়।
প্রশ্ন ॥ ১৬ ॥ গামা রশ্মি কী কাজে ব্যবহৃত হয়?
উত্তর : গামা রশ্মি ব্যাকটেরিয়াসহ অনেক জীবাণু ধ্বংসে ব্যবহৃত হয়। খাদ্যদ্রব্য বা ফলমূল সংরক্ষণের সময় যেন ব্যাকটেরিয়া আক্রমণ করতে না পারে সেজন্য মূলত এই রশ্মি ব্যবহৃত হয়।
প্রশ্ন ॥ ১৭ ॥ দুটি মৌল A এবং B এর পারমাণবিক সংখ্যা যথাক্রমে 11 এবং 17। ইলেকট্রন বিন্যাস লিখে এই মৌলদ্বয় শনাক্ত কর।
উত্তর : A মৌলের পারমাণবিক সংখ্যা 11 অর্থাৎ এর ইলেকট্রন বিন্যাস 2, 8, 1।
সুতরাং মৌলটির নাম Na।
B মৌলের পারমাণবিক সংখ্যা 17 অর্থাৎ এর ইলেকট্রন বিন্যাস 2, 8, 7।
সুতরাং মৌলটির নাম Cl.
এসএসসি বাংলা দ্বিতীয় পত্র সাজেশন ও বহুনির্বাচনি প্রশ্নোত্তর পেতে এখানে ক্লিক করুন
প্রশ্ন ॥ ১৮ ॥ একটি পরমাণুর প্রথম কক্ষে 2টি, দ্বিতীয় কক্ষে ৪টি এবং তৃতীয় কক্ষে 3টি ইলেকট্রন আছে মৌলটি শনাক্ত কর।
উত্তর : 2, 8, 3 ইলেকট্রন বিন্যাস সমৃদ্ধ মৌলটি হলাে অ্যালুমিনিয়াম।
প্রশ্ন ॥ ১৯ ॥ কী কারণে আইসােটোপগুলাে একটি থেকে অন্যটি ভিন্ন হয়?
উত্তর : আইসােটোপগুলাের পারমাণবিক সংখ্যা অর্থাৎ প্রােটন সংখ্যা একই কিন্তু নিউক্লিয়াসে নিউট্রন সংখ্যা বিভিন্ন হওয়ায় ভিন্ন ভবিশিষ্ট আইসােটোপের পরমাণু পাওয়া যায়। এ কারণে আইসােটোপগুলাে একটি থেকে অন্যটি ভিন্ন হয়।
প্রশ্ন ॥ ২০ ॥ অক্সিজেনের ভর সংখ্যা 16 বলতে কী বােঝায়?
উত্তর : অক্সিজেনের ভর সংখ্যা 16 বলতে বােঝায় যে, অক্সিজেন পরমাণুর নিউক্লিয়াসে মােট 16টি প্রােটন ও নিউট্রন আছে।
প্রশ্ন ॥ ২১ ॥ সােডিয়ামের পারমাণবিক সংখ্যা 11 বলতে কী বােঝ?
উত্তর : সােডিয়ামের পারমাণবিক সংখ্যা 11 বলতে বােঝায় যে, সােডিয়াম পরমাণুর নিউক্লিয়াসে 11টি প্রােটন আছে।
প্রশ্ন ॥ ২২ ॥ বর্ণালি বলতে কী বােঝ?
উত্তর : বর্ণালি হলাে বিভিন্ন বর্ণর আলাের সমাবেশ। কক্ষপথ থেকে ইলেকট্রন স্থানান্তরের সময় বিকিরিত ও শােষিত শক্তিকে বর্ণালি হিসেবে পাওয়া যায়। বৃষ্টির পর আকাশে সূর্যের বিপরীত পাশে বর্ণালি দেখা যায়। এই বর্ণালিও পরমাণু থেকে প্রাপ্ত বর্ণালি দেখতে একই রকম।
প্রশ্ন ॥ ২৩ ॥ অরবিটালসমূহের শক্তিক্রম কীরূপ?
উত্তর : পরমাণুর ইলেকট্রন বিন্যাসের সময় ইলেকট্রনসমূহ বিভিন্ন অরবিটালে (উপ-শক্তিস্তরে) তাদের শক্তির নিম্নক্রম থেকে উচ্চক্রম অনুসারে প্রবেশ করে। স্থিতিশীলতা অর্জনের জন্য প্রথমে নিম্নশক্তির অরবিটালে ইলেকট্রন গমন করে এবং অরবিটাল পূর্ণ করে। এভাবে, ক্রমান্বয়ে উচ্চ শক্তির অরবিটাল ইলেকট্রন দ্বারা পূর্ণ হয়। অরবিটালসমূহের শক্তিক্রম নিম্নরূপ:
1s <2s< 2p <3s <3p <4s <3d < 4p <5s <4d <5p < 6s <4f < 5d < 6p <7s <5f<6d <7p < 8s
গুরুত্বপূর্ণ বহুনির্বাচনি প্রশ্নোত্তর
১. একটি মৌলের একটি পরমাণুর প্রকৃত ভর যদি 4.482 × 10-23 গ্রাম হয়, তবে এর আপেক্ষিক পারমাণবিক ভর হবে-
ক. 25 খ. 40
গ. 29 ঘ.27
উত্তর: ঘ. 27
২. N শেলে (অরবিট) কয়টি উপশক্তিস্তর থাকে?
ক.1 খ. 2
গ. 3 ঘ. 4
উত্তর: ঘ. 4
৩. পটাশিয়ামের পারমাণবিক সংখ্যা কত?
ক. 15 খ. 17
গ. 19 ঘ. 21
উত্তর: গ. 19

i. প্রােটন সংখ্যা 13
ii. ভর সংখ্যা 27
iii. ইলেকট্রন ইলেকট্রন সংখ্যা 10
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iiiঘ. i, ii ও iii
উত্তর: ক. i ও ii
৫. Sc এর পারমাণবিক সংখ্যা 21। Sc এর সঠিক ইলেকট্রন বিন্যাস কোনটি?
ক. 1s2 2s2 2p6 3s2 3p6 4s1
খ. 1s2 2s2 2p63s23p6 4s2
গ. 1s2 2s2 2p6 3s2 3p6 3d1 4s2
ঘ. 1s2 2s2 2p6 3s2 3p6 3d4
উত্তর: গ. 1s2 2s2 2p6 3s2 3p6 3d1 4s2
৬. নাইট্রিক এসিডের আপেক্ষিক আণবিক ভর কত?
ক. 44 খ. 52
গ. 63 ঘ. 98
উত্তর: গ. 63
৭. ‘X’ মৌলটির আপেক্ষিক পারমাণবিক ভর কত?
| আইসোটোপ | পর্যাপ্ততার শতকরা পরিমাণ |
| 146X | 25 |
| 154X | 75 |
[এখানে x প্রতীকী অর্থে প্রচলিত কোনো মৌলের প্রতীক নয়]
ক. 148 খ. 150
গ. 152 ঘ. 153
উত্তর: গ. 152
৮. নিচের কোন আইসোটোপটি চিকিৎসা ও কৃষি উভয় ক্ষেত্রে ব্যবহৃত হয়?
ক. 131I খ. 125I
গ. 32P ঘ. 153Sm
উত্তর: গ. 32P
৯. 5626Yমৌলটির–
i. একাধিক যোজনী বিদ্যমান
ii. প্রােটন ও নিউট্রন সংখ্যা ভিন্ন
iii. ইলেকট্রন বিন্যাস স্বাভাবিক নিয়মের
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
১০. অক্সিজেনের আপেক্ষিক আণবিক ভর কত?
ক. 8 খ. 16
গ. 32 ঘ. 64
উত্তর: খ. 16
১১. Ca2+ আয়নে ইলেকট্রন সংখ্যা কতটি?
ক. 22 খ. 20
গ. 18 ঘ. 16
উত্তর: গ. 18
১২. Cu এর সর্বশেষ স্তরের ইলেকট্রন বিন্যাস –
ক 3s2 খ. 4s1
গ. 4s0 ঘ. 3d10
উত্তর: খ. 4s1
১৩. H+ আয়নে কতটি নিউট্রন আছে?
ক. 0 খ.1
গ.2 ঘ.3
উত্তর: ক. 0
১৪. ক্রিপ্টনের পারমাণবিক সংখ্যা কত?
ক. 86 খ. 54
গ. 36 ঘ.18
উত্তর: গ. 36
১৫. CuSO4 এর আপেক্ষিক আণবিক ভর কত?
ক. 111.5 খ. 125.0
গ. 143.5 ঘ.159.5
উত্তর: ঘ.159.5
নিচের অনুচ্ছেদটি পড়ে ১৬ ও ১৭ নং প্রশ্নের উত্তর দাও :
১৬. A মৌলটির কয়টি আইসোটোপ আছে?
ক. 2টি খ. 3টি
গ. 4টি ঘ.5টি
উত্তর: খ. 3টি
১৭. A মৌলটি –
i. B এর সাথে অক্সাইড গঠন করে
ii. C এর সাথে সমযােজী বন্ধন গঠন করে
iii. AB পানির সাথে এসিড উৎপন্ন করে
নিচের কোনটি সঠিক?
ক i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: খ. i ও iii
ICT তৃতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
১৮. লেডের ল্যাটিন নাম কী?
ক. Argentum খ. Stannum
গ. Hydrargyrum ঘ. Plumbum
উত্তর: ঘ. Plumbum
১৯. নিচের বাক্যগুলো লক্ষ কর :
i. বােরনের প্রতীক B
ii. অ্যালুমিনিয়ামের প্রতীক Al
iii. ক্রোমিয়ামের প্রতীক Cr
নিচের কোনটি সঠিক?
ক i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
২০. একটি মৌলের প্রোটন সংখ্যা 23 এবং ভর সংখ্যা 47 হলে এর নিউট্রন সংখ্যা কত?
ক. 20 খ. 24
গ. 53 ঘ. 70
উত্তর: খ. 24
২১. পরমাণুর ধনাত্মক কণিকা কোনটি?
ক. প্রোটন খ. ইলেকট্রন
গ. নিউট্রন ঘ. নিউক্লিয়াস
উত্তর: ক. প্রোটন
২২. N পরমাণুতে কতটি নিউট্রন আছে?
ক. 5টি খ. 7টি
গ. 6টি ঘ. ৪টি
উত্তর: খ. 7টি
২৩. A এর প্রােটন সংখ্যা 13, এর একটি পরমাণুর ভর যদি 4.482 x 10-24g হয়, এর আপেক্ষিক পারমাণবিক ভর কত?
ক. 27 খ. 26
গ. 25 ঘ. 13
উত্তর: ক. 27
২৪. নীলস বাের কত সালে তার বিখ্যাত পরমাণু মডেল প্রকাশ করেন?
ক. 1798 খ.1911
গ. 1913 ঘ. 1803
উত্তর: গ. 1913
২৫. পরমাণুতে নিউক্লিয়াসের অবস্থানের ধারণা দেন কোন বিজ্ঞানী?
ক ডাল্টন খ. রাদারফোর্ড
গ. ম্যাক্সওয়েল ঘ. নীলসবোর
উত্তর: খ. রাদারফোর্ড
২৬. বোর পরমাণু মডেলের সীমাবদ্ধতা কোনটি?
ক. এটি পরমাণুসমূহের বর্ণালীরেখা ব্যাখ্যা করতে পারে না
খ. এটি হাইড্রোজেন ও এর বর্ণালী রেখার ব্যাখ্যা দিতে সক্ষম না
গ. এটি ইলেকট্রনের অবস্থান সম্পর্কে সঠিক ধারণা দিতে সক্ষম না
ঘ. এটি পরমাণুর ভর সম্পর্কে সঠিক ধারণা দিতে সক্ষম না
উত্তর: ক. এটি পরমাণুসমূহের বর্ণালীরেখা ব্যাখ্যা করতে পারে না
২৭. পরমাণুতে শক্তিস্তরের ধারণা দেন কোন বিজ্ঞানী?
ক. নীলস বোর খ. রাদারফোর্ড
গ. ম্যাক্সওয়েল ঘ. মেন্ডেলিফ
উত্তর: ক. নীলস বোর
২৮. কোন কণিকা তড়িৎ নিরপেক্ষ?
ক. ইলেকট্রন খ. প্রােটন
গ. নিউট্রন ঘ. পজিট্রন
উত্তর: গ. নিউট্রন
২৯. ইলেকট্রনের আপেক্ষিক আধান কত?
ক. +1 খ. -1
গ. +2 ঘ. 0
উত্তর: খ. -1
৩০. একটি নিউট্রনের প্রকৃত ভর কত?
ক.1.675 x 10-24g খ. 1.56 x 10-24g
গ. 9.11 x 10-24g ঘ. 9.67 x 10-24g
উত্তর: ক.1.675 x 10-24g
৩১. প্রােটনের প্রকৃত আধান কোনটি?
ক. 1.67 x 10-24g খ. 1.60 x 10-19 c
গ. 1.675×10-24g ঘ. 0 (শূন্য)
উত্তর: খ. 1.60 x 10-19 c
৩২. ইলেকট্রনের প্রকৃত আধান কত?
ক. 1.60 x 10-19c খ. 1.70 x 10-19c
গ. 1.80 x 10-19c ঘ. -1.60 x 10-19c
উত্তর: ঘ. -1.60 x 10-19c
৩৩. ইলেকট্রনের প্রকৃত ভর কত?
ক. 1.67 x 10-24g খ. 9.11 x 10-24g
গ. 1.675 x 10-24g ঘ. 9.11 x 10-28g
উত্তর: ঘ. 9.11 x 10-28g
৩৪. পারমাণবিক সংখ্যা কী?
ক. প্রােটন সংখ্যা খ. ইলেকট্রন সংখ্যা
গ. নিউট্রন সংখ্যা ঘ. প্রােটন ও ইলেকট্রন সংখ্যা
উত্তর: ক. প্রােটন সংখ্যা
৩৫. একটি ইলেকট্রন একটি প্রােটন থেকে কতগুণ হালকা?
ক. 1839 খ. 1819
গ. 1840 ঘ. 1901
উত্তর: গ. 1840
৩৬. H2SO4 এর আপেক্ষিক ভর 98 হলে, একটি অণুর ভর কত?
ক. 1.62 x 1022g খ. 1.62 x 10-22g
গ. 5.90 x 1025g ঘ. 1.62 x 10-23g
উত্তর: খ. 1.62 x 10-22g
৩৭. রাদারফোর্ডের পরমাণু গঠনের সীমাবদ্ধতা হলো-
i. এই মডেলে বর্ণালী গঠনের ব্যবস্থা আছে
ii. একাধিক ইলেকট্রন বিশিষ্ট পরমাণুতে নিউক্লিয়াসকে ঘিরে ইলেকট্রনের পরিক্রমণ এ মডেলে নেই
iii. আবর্তনশীল ইলেকট্রনের কক্ষপথ সম্পর্কে কোনাে সুনির্দিষ্ট ধারণা নেই
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও ii
উত্তর: গ. ii ও iii
৩৮. তেজস্ক্রিয় আইসােটোপ-
i. নিউক্লিয় বিক্রিয়ার মাধ্যমে প্রস্তুত হয়
ii. অত্যন্ত গতিসম্পন্ন রশ্মি নির্গত করে
iii. গবেষণাগারে সংশ্লেষিত হয় নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
৩৯. নিউক্লিয়ার বিক্রিয়ায়–
i. তাপ উৎপন্ন হয়
ii. বিদ্যুৎ উৎপন্ন হয়
iii. তেজস্ক্রিয় রশ্মি নির্গত হয়
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ঘ. i, ii ও iii
রসায়ন দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
৪০. আইসােটোপের-
i. রাসায়নিক ধর্ম ভিন্ন
ii. পরমাণু একই মৌলের
iii. ভর সংখ্যা একই থাকে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
উত্তর: ক. i ও ii
গুরুত্বপূর্ণ সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন –১: নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলাের উত্তর দাও :
একটি মৌলের পরমাণুর মডেল আঁকার জন্য বলা হলে নবম শ্রেণির ছাত্র ফরিদ নিচের চিত্রটি অঙ্কন করল।
ক. পারমাণবিক সংখ্যা কাকে বলে?
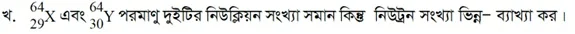
গ. ফরিদের আঁকা মডেলটি যে পরমাণু মডেলকে নির্দেশ করে তা ব্যাখ্যা কর।
ঘ. অঙ্কিত মডেল অনুসারে পরমাণুর স্থায়িত্ব সম্পর্কে যৌক্তিক মতামত দাও।
১নং প্রশ্নের উত্তর
ক. কোনো মৌলের পরমাণুর নিউক্লিয়াসে বা কেন্দ্রে যত সংখ্যক প্রোটন থাকে, সেই সংখ্যাকে ঐ মৌলের পারমাণবিক সংখ্যা বলে।
খ. নিউক্লিয়ন সংখ্যা হচ্ছে প্রোটন ও নিউট্রন সংখ্যার যোগফল।
সুতরাং নিউট্রন সংখ্যা = নিউক্লিয়ন সংখ্যা বা ভরসংখ্যা (A) – প্রোটন সংখ্যা বা পারমাণবিক সংখ্যা (Z)।

যথাক্রমে 29, 30 এবং নিউক্লিয়ন সংখ্যা বা ভরসংখ্যা যথাক্রমে 64, 64; অর্থাৎ, মৌল দুটির পারমাণবিক সংখ্যা বা প্রোটন সংখ্যা ভিন্ন। তাই নিউক্লিয়ন সংখ্যা সমান হলেও, নিউট্রন সংখ্যা ভিন্ন হবে।
গ. ফরিদের আঁকা মডেলটি রাদারফোর্ড পরমাণু মডেলকে সমর্থন করে। নিম্নে রাদারফোর্ডের পরমাণু মডেলটি সম্পর্কে স্পষ্ট ধারণা পাওয়া যায়। নিচে মডেলটি ব্যাখ্যা করা হলাে :
১. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারি বস্তু বিদ্যমান। এই ভারি বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মােট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভূত।
২. পরমাণু বিদ্যুৎনিরপেক্ষ । অতএব নিউক্লিয়াসের ধনাত্মক চার্জযুক্ত প্রােটন সংখ্যার সমান সংখ্যক ঋণাত্মক চার্জযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে। সৌরজগতের সূর্যের চারদিকে ঘূর্ণায়মান গ্রহসমূহের মতো পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসের চারদিকে অবিরাম ঘুরছে। ধনাত্মক চার্জবিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনসমূহের পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বহির্মুখী বল পরস্পর সমান।
ঘ. উদ্দীপকে বিদ্যমান অঙ্কিত মডেল বিশ্লেষণ করলে দেখা যায়, ইলেকট্রনগুলো সর্পিলাকারে ঘুরতে ঘুরতে নিউক্লিয়াসে পতিত হচ্ছে, তাই অঙ্কিত মডেলটি একটি অস্থায়ী পরমাণু মডেল। ‘গ’ থেকে জানা যায়, অঙ্কিত মডেলটি রাদারফোর্ডের পরমাণু মডেলকে সমর্থন করে। এই মডেলের ৩য় স্বীকার্য অনুযায়ী ইলেকট্রনগুলো নিউক্লিয়াসের চারদিকে ঘোরে। এ সময় ধনাত্মক চার্জবিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনসমূহের পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বহির্মুখী বল পরস্পর সমান থাকে। তাই এটি স্থায়িত্ব লাভ করবে। কিন্তু, ম্যাক্সওয়েলের মতবাদ অনুসারে এই পরমাণু মডেলটির স্থায়ীত্ব লাভ করা সম্ভব নয়। কারণ, কোনো চার্জযুক্ত বস্তু বা কণা কোনো বৃত্তাকার পথে ঘুরতে থাকলে তা ক্রমাগত শক্তি বিকিরণ করবে এবং আবর্তন চক্রও ধীরে ধীরে কমতে থাকবে। যেহেতু ইলেকট্রন ঋণাত্মক চার্জযুক্ত, তাই ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে প্রবেশ করবে। অর্থাৎ, অঙ্কিত পরমাণু মডেল অনুসারে পরমাণু সম্পূর্ণভাবে একটি অস্থায়ী অবস্থাপ্রাপ্ত হবে।
প্রশ্ন –২ : নিচের তথ্যের আলোকে প্রশ্নগুলোর উত্তর দাও :
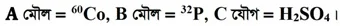
ক. প্রতীক কাকে বলে?
খ. পরমাণুতে কখন বর্ণালির সৃষ্টি হয় – ব্যাখ্যা কর।
গ. C যৌগের আপেক্ষিক আণবিক ভর বের করো।
ঘ. A এবং B এর আইসোটোপগুলো আমাদের জীবনে গুরুত্বপূর্ণ ভূমিকা রাখে- বিশ্লেষণ কর।
২নং প্রশ্নের উত্তর
ক. কোনো মৌলের পূর্ণ নামের সংক্ষিপ্ত প্রকাশকে ঐ মৌলের প্রতীক বলে।
খ. বর্ণালি হলো বিভিন্ন বর্ণের আলোর সমাবেশ। বোর পরমাণু মডেল অনুসারে পরমাণুর মধ্যে কোনো ইলেকট্রন যখন একটি নিম্নতর কক্ষপথ থেকে উচ্চতর কক্ষপথে স্থানান্তরীত হয় তখন নির্দিষ্ট পরিমাণ শক্তি শোষণ করে। আবার যখন উচ্চতর শক্তিস্তর থেকে নিম্নতর শক্তিস্তরে স্থানান্তরিত হয় তখন নির্দিষ্ট পরিমাণ শক্তি বিকিরণ করে। বিকিরিত ও শোষিত শক্তিকে বর্ণালি হিসাবে পাওয়া যায়। এভাবে পরমাণুতে বর্ণালির সৃষ্টি হয়।
গ. কোনো মৌলিক বা যৌগিক পদার্থের অণুতে যে পরমাণুগুলো থাকে তাদের আপেক্ষিক পারমাণবিক ভরকে নিজ নিজ পরমাণু সংখ্যা দিয়ে গুণ করে যোগ করলে প্রাপ্ত যোগফলই হলো ঐ অণুর আপেক্ষিক আণবিক ভর। আপেক্ষিক আণবিক ভরকে সাধারণভাবে আণবিক ভর হিসেবে বিবেচনা করা হয়। এখানে C যৌগটি হলো: H2SO4 ।
বাংলা প্রথম পত্র সাজেশন পেতে এখানে ক্লিক করুন
H2SO4 এর অণুতে উপস্থিত হাইড্রোজেন (H) এর আপেক্ষিক পারমাণবিক ভর 1এবং পরমাণু সংখ্যা 2, সালফার (S) পরমাণুর আপেক্ষিক পারমাণবিক ভর 32 এবং পরমাণু সংখ্যা 1 এবং অক্সিজেন (O) পরমাণুর আপেক্ষিক পারমাণবিক ভর 16 এবং পরমাণু সংখ্যা 4।
অতএব, H2SO4 এর আপেক্ষিক আণবিক ভর হবে, 1×2 + 32×1 + 16×4 =2 + 32 + 64 = 98। .:. C যৌগটির আণবিক ভর 98।
ঘ. উল্লেখিত A ও B মৌলের আইসোটোপ দুটি হলো তেজস্ক্রিয় আইসোটোপ। যে সকল আইসোটোপের নিউক্লিয়াস স্বত:স্ফুর্তভাবে ভেঙ্গে আলফা রশ্মি, বিটা রশ্মি, গামা রশ্মি ইত্যাদি নির্গত করে তাদেরকে তেজস্ক্রিয় আইসোটোপ বলে। বর্তমানে এই তেজস্ক্রিয় আইসোটোপ চিকিৎসাক্ষেত্রে, কৃষিক্ষেত্রে, খাদ্য ও বীজসংরক্ষণে, বিদ্যুৎ উৎপাদনে এবং কোনো কিছুর বয়স নির্ণয়সহ আরও অনেক ক্ষেত্রে ব্যবহার করা হয়।
আমাদের জীবনে 60Co ও 32P আইসোটোপগুলোর ভূমিকা বিশ্লেষণ করা হলো:
চিকিৎসা ক্ষেত্রে : রোগ নিরাময়ে 60Co তেজস্ক্রিয় আইসোটোপ টিউমারের উপস্থিতি নির্ণয় ও নিরাময়ে ব্যবহার করা হয়। 60Co থেকে গামা রশ্মি ক্যান্সারের কোষকলাকে ধ্বংস করে। তাই ক্যান্সার চিকিৎসায় কেমোথেরাপিতে তেজস্ক্রিয় আইসোটোপ 60Co ব্যবহৃত হয়। আবার, রক্তের লিউকেমিয়া রোগের চিকিৎসায় 32p এর ফসফেট ব্যবহার করা হয়।
কৃষিক্ষেত্রে : তেজস্ক্রিয় রশ্মি ব্যবহার করে কৃষিক্ষেত্রে নতুন নতুন উন্নত মানের বীজ উদ্ভাবন করা হচ্ছে। এ প্রক্রিয়ায় ফলনের মানের উন্নতি ও পরিমাণ বাড়ানো হচ্ছে। তেজস্ক্রিয় আইসোটোপ ব্যবহার করে জমিতে কী পরিমাণ নাইট্রোজেন ও ফসফরাস প্রয়োজন তার হিসাব করা যায়। উদ্ভিদ তেজস্ক্রিয় ফসফরাস মূলের মাধ্যমে গ্রহণ করে এবং তা উদ্ভিদের শরীরের বিভিন্ন অংশে শোষিত হয়। এ সকল তেজস্ক্রিয় আইসোটোপ থেকে তেজস্ক্রিয় রশ্মি নির্গত হয়। গাইগার মূলার কাউন্টার ব্যবহার করে এ তেজস্ক্রিয় রশ্মি শনাক্ত ও পরিমাপ করা হয়।
এছাড়াও তেজস্ক্রিয় আইসোটোপসমৃদ্ধ কীটনাশক ব্যবহারের মাধ্যমে জানা সম্ভব হয়েছে সর্বনিম্ন কতটুকু পরিমাণ কীটনাশক একটি ফসলের জন্য ব্যবহার করা যায়।
খাদ্য সংরক্ষণে : সকল প্রকার শাক-সবজি, ফল সঠিক সংরক্ষণের অভাবে বা রান্নাপ্রক্রিয়া সঠিক না হলে বিভিন্ন ধরনের ক্ষতিকর ব্যাকটেরিয়ার জন্ম হয় যা আমাদের শরীরের জন্য ক্ষতিকর। ক্ষেত্রবিশেষে মৃত্যুর কারণ পর্যন্ত হতে পারে। সাধারণত 60Co থেকে যে গামা রশ্মি নির্গত হয় তা এসব ক্ষতিকর ব্যাকটেরিয়াকে মেরে ফেলে। পোলট্রি ফার্মেও এ রশ্মি ব্যবহার করা হয় যখন কোনো ব্যাকটেরিয়াজনিত রোগের উদ্ভব ঘটে।
উদ্দিপকে উল্লেখিত A ও B এর আইসোটোপ দুইটির ভূমিকা আমাদের জীবনে অপরিসীম।
প্রশ্ন –৩: নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলাের উত্তর দাও :
নবম শ্রেণির রসায়ন শিক্ষক অভিজিৎ রায় তার শিক্ষার্থীদেরকে পরমাণুর গঠন সম্পর্কে বোঝানোর সময় একটি পরমাণুর সৌর মডেলের প্রস্তাবনা সম্পর্কে বোঝাচ্ছিলেন। অতঃপর, তিনি শিক্ষার্থীদেরকে উক্ত মডেলের প্রস্তাবনাগুলোর সীমাবদ্ধতা নিজেদের মধ্যে আলোচনার মাধ্যমে খুঁজে বের করতে বললেন।
ক. নিউক্লিয় বিক্রিয়ার ক্ষতিকর প্রভাব কী?
খ. তেজস্ক্রিয় রশ্মি সূর্যের আলোর ন্যায় নিরাপদ কখন?
গ. উদ্দীপকের শিক্ষক কর্তৃক বর্ণিত পরমাণু মডেলটির প্রস্তাবনাগুলো তুলে ধর।
ঘ. উদ্দীপকের পরমাণু মডেলের প্রতটি প্রস্তাবনা ভালোভাবে বিশ্লেষণপূর্বক সীমাবদ্ধতাসমূহ আলোচনা কর।
৩নং প্রশ্নের উত্তর
ক. নিউক্লিয়ার বিক্রিয়া হলো হিরোসিমা ও নাগাসাকিতে নিক্ষিপ্ত এটম বোমাসহ সব ধরনের পারমাণবিক বোমার শক্তির উৎস।
খ. তেজস্ক্রিয় পদার্থ থেকে নির্গত রশ্মিকে তেজস্ক্রিয় রশ্মি বলা হয়।
অতিরিক্ত তেজস্ক্রিয় রশ্মির ব্যবহার স্বাস্থ্যের জন্য মারাত্মক ক্ষতিকর খাদ্যদ্রব্যে ব্যবহারের ক্ষেত্রে তেজস্ক্রিয় রশ্মি অবশ্যই পরিমিত মাত্রায় সংরক্ষিত স্থানে প্রয়োগ করতে হবে। পরিমিত মাত্রায় এ তেজস্ক্রিয় রশ্মি (গামা রশ্মি)-র ব্যবহার সূর্যের আলোর ন্যায় নিরাপদ।
গ. উদ্দীপকের শিক্ষক কর্তৃক বর্ণিত পরমাণুর মডেলটিকে পরমাণুর সৌর মডেল বা রাদারফোর্ডের পরমাণু মডেল বলে। এ মডেলটির প্রস্তাবনাগুলো নিম্নরূপ :
i. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক আধান ও প্রায় সমস্ত ভর কেন্দ্রীভূত।
ii. পরমাণু বিদ্যুৎনিরপেক্ষ । অতএব নিউক্লিয়াসের ধনাত্মক আধানযুক্ত প্রোটন সংখ্যার সমান সংখ্যক ঋনাত্মক আধানযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে।
iii. সৌরজগতের সূর্যের চারিদিকে ঘূর্ণায়মান গ্রহসমূহের মতো পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসের চারিদিক অবিরাম ঘুরছে। ধনাত্মক আধান বিশিষ্ট নিউক্লিয়াস ও ঋনাত্মক আধান বিশিষ্ট ইলেকট্রনসমূহের পারস্পারিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বর্যিমুখী বল পরপর সমান।
ঘ. উদ্দীপকে উল্লেখিত পরমাণু মডেলটির প্রস্তাবনাগুলো ভালোভাবে বিশ্লেষণের পর প্রাপ্ত সীমাবদ্ধতাসমূহ নিম্নে আলোচিত হলো :
i. সৌরমন্ডলের গ্রহসমূহ সামগ্রিকভাবে চার্জবিহীন অথচ ইলেকট্রনসমূহ ঋণাত্মক চার্জযুক্ত।
ii. ম্যাক্সওয়েলের তত্ত্বানুসারে কোনো চার্জযুক্ত বস্তু বা কণা বৃত্তাকার কক্ষপথে ঘুরতে থাকলে তা ক্রমাগত শক্তি বিকিরণ করবে এবং আবর্তনচক্রও ধীরে ধীরে ছোট হতে থাকবে। সুতরাং, ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে প্রবেশ করবে। সুতরাং, রাদারফোর্ডের পরমাণু মডেল অনুসারে পরমাণু সম্পূর্ণভাবে একটি অস্থায়ী অবস্থা প্রাপ্ত হবে। অথচ পরমাণু হতে ক্রমাগত শক্তি বিকিরণ বা ইলেকট্রনের নিউক্লিয়াসে প্রবেশ কখনোই ঘটে না।
iii. পরমাণুর বর্ণালি গঠনের কোনো সুষ্ঠু ব্যাখ্যা এ মডেল দিতে পারে না।
iv. আবর্তনশীল ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোনো ধারণা এ মডেলে দেওয়া হয় নি।
v. একাধিক ইলেকট্রনবিশিষ্ট পরমাণুতে ইলেকট্রনগুলো নিউক্লিয়াসকে কীভাবে পরিভ্রমণ করে তার কোনো উল্লেখ এ মডেলে নেই ।
প্রশ্ন–৪: নিচের মৌল দুটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
i. 13A1 ii. 19K
ক. অরবিট কী?
খ, তেজস্ক্রিয় আইসোটোপ বলতে কী বুঝ?
গ. (i) নং মৌলের আপেক্ষিক পারমাণবিক ভর 27 হলে, মৌলটির একটি পরমাণুর ভর নির্ণয় কর।
ঘ. (ii) নং মৌলের শেষ ইলেকট্রনটি 3d অরবিটালে না গিয়ে 4s অরবিটালে যাওয়ার কারণ বিশ্লেষণ কর।
৪ নং প্রশ্নের উত্তর
ক. অরবিট হলো নিউক্লিয়াসের চারদিকে বৃত্তাকার কতগুলো স্থির কক্ষপথ বা শক্তিস্তর যাতে অবস্থান নিয়ে ইলেকট্রনসমূহ ঘুরতে থাকে।
খ. যেসব আইসোটোপ বিভিন্ন ধরনের রশ্মি যেমন- α (আলফা), B (বিটা), γ (গামা) ইত্যাদি বিকিরণ করে অন্য মৌলের আইসোটোপে পরিণত হয় তাদের তেজস্ক্রিয় আইসোটোপ বলে। প্রকৃতিতে বিদ্যমান আইসোটোপগুলোর মধ্যে অধিকাংশই অস্থিত যারা অবিরাম স্বতঃস্ফূর্তভাবে বিভিন্ন রশ্মি বিকিরণ করে। প্রকৃতপক্ষে এ সকল পরমাণুর নিউক্লিয়াসে পরিবর্তন ঘটে। প্রমাণু থেকে নির্গত সেসব রশ্মি অধিক গতিসম্পন্ন। এসব তেজস্ক্রিয় আইসোটোপ নিউক্লিয়ার বিক্রিয়ার মাধ্যমেও তৈরি করা যায়।
গ. (i) নং মৌলের আপেক্ষিক পারমাণবিক ভর 27 হলে, কার্বন- 12 আইসোটোপের ভরের 1/12 অংশ ব্যবহার করে মৌলটির একটি পরমাণুর ভর নির্ণয় করা যায়। কারণ, মৌলের আপেক্ষিক পারমাণবিক ভর =
মৌলের একটি পরমাণুর ভর/একটি কার্বন-12 আইসোটোপের ভরের 1/12 অংশ
বা, একটি পরমাণুর ভর = আপেক্ষিক পারমাণবিক ভর x একটি কার্বন12 আইসোটোপের ভরের 1/12 অংশ। আমরা জানি, কার্বন- 12 আইসোটোপের ভরের 1/12 অংশের ভর হলো 1.66 x 10-24g. সুতরাং, (i) নং মৌলের একটি পরমাণুর ভর = (27 x 1.66 x 10-24)g = 4.482 x 10-22g.
ঘ. (ii) নং মৌলটি হলো 19K। এর ইলেকট্রন বিন্যাস নিম্নরূপ:
19K →2, 8, 8,1→ 1s22s22p63s23p63d04s1
দেখা যাচ্ছে, মৌলটির শেষ ইলেকট্রনটি 3d অরবিটালে না গিয়ে 4s অরবিটালে প্রবেশ করেছে। আমরা জানি, মৌলসমূহের ইলেকট্রনকে বিভিন্ন শক্তিস্তরে ধারণক্ষমতা অনুসারে সাজানো যায়। নিম্ন শক্তিস্তর ইলেকট্রন দ্বারা পূর্ণ হলে পরবর্তী শক্তিস্তরে ইলেকট্রন প্রবেশ করে। সে হিসেবে 19K এর ইলেকট্রন বিন্যাস হতে পারত 1s22s22p63s23p6d1।
জীববিজ্ঞান দ্বিতীয় অধ্যায় সাজেশন পেতে এখানে ক্লিক করুন
কিন্তু, চতুর্থ শক্তিস্তরের s উপস্তরের শক্তি তৃতীয় শক্তিস্তরের d উপস্তরের তুলনায় কম। আর ইলেকট্রনসমূহের সাধারণ ধর্ম হচ্ছে এরা প্রথমে নিম্ন শক্তিসম্পন্ন উপস্তর পূর্ণ করে এবং ক্রমান্বয়ে উচ্চ শক্তিসম্পন্ন উপস্তরে গমন করে। অর্থাৎ, পরমাণুর ইলেকট্রন বিন্যাসের সময় ইলেকট্রনসমূহ বিভিন্ন অরবিটালে (উপশক্তিস্তরে) তাদের শক্তির নিম্নক্রম থেকে উচ্চক্রম অনুসারে প্রবেশ করে স্থিতিশীলতা অর্জনের জন্য প্রথমে নিম্নশক্তির অরবিটালে ইলেকট্রন গমন করে এবং অরবিটাল পূর্ণ করে। এরপর ক্রমান্বয়ে উচ্চশক্তির অরবিটাল ইলেকট্রন দ্বারা পূর্ণ হয়। অরবিটালসমূহের শক্তিক্রম নিম্নরূপ :
1s <2s <2p <3s <3p <4s <3d এই নীতি অনুসরণ করে আমরা K(19) এর ইলেকট্রন বিন্যাস দেখাতে পারি,
K (19) → 1s22s22p63s23p63d04s1 যেহেতু 4s অরবিটালের শক্তি 3d অরবিটালের শক্তির চেয়ে কম, তাই পটাসিয়ামের সর্বশেষ ইলেকট্রনটি 3d অরবিটালে না প্রবেশ করে 4s অরবিটালে স্থান নিয়েছে।
প্রশ্ন-৫: নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
শ্রেণিকক্ষে শিক্ষক পরমাণুর মডেল আঁকতে বললেন। সুমন A মডেলটি এবং সুমনা B মডেলটি আঁকল।
ক. অরবিটাল কী?
খ. পটাসিয়ামের 19-তম ইলেকট্রনটি 3d অরবিটালে প্রবেশ করে 4s অরবিটালে প্রবেশ করে কেন?
গ. উদ্দীপকের B মডেলের আলোকে পরমাণুর X ও Y শক্তিস্তরের অরবিটালের সংখ্যা ও ধারণকৃত ইলেকট্রন
সংখ্যা হিসাব কর।
ঘ. উদ্দীপকের দুটি মডেলের তুলনামূলক অবস্থান তুলে ধর।
৫নং প্রশ্নের উত্তর
ক. অরবিটাল হলো পরমাণুতে নিউক্লিয়াসের চারপাশে বিদ্যমান অনুমোদিত বৃত্তাকার কক্ষপথ বা শক্তিস্তরের উপশক্তিস্তর।
খ. 3d অরবিটালের চেয়ে 4s অরবিটালের ইলেকট্রন ধারণক্ষমতা কম বলে পটাশিয়ামের 19 তম ইলেকট্রনটি 3d অরবিটালে প্রবেশ না করে 4s অরবিটালে প্রবেশ করে। পটাসিয়ামের ইলেকট্রন বিন্যাসটি হলো:
19K →2, 8, 8,1→ 1s22s22p63s23p63d04s1 দেখা যাচ্ছে যে 3d অরবিটাল পর্যন্ত 18টি ইলেকট্রন প্রবেশ করার পর 19 তম ইলেকট্রনটি 3d অরবিটালে প্রবেশ করার কথা থাকলেও তা না হয়ে 4s অরবিটালে প্রবেশ করেছে। কারণ, মৌলের পরমাণুতে ইলেকট্রনসমূহ বিভিন্ন শক্তিস্তরে ধারণক্ষমতা অনুসারে সজ্জিত হয়। যেহেতু 4s অরবিটালের শক্তি 3d অরবিটালের শক্তির চেয়ে কম, তাই পটাসিয়ামের সর্বশেষ ইলেকট্রনটি 3d অরবিটালে
প্রবেশ না করে 4s অরবিটালে প্রবেশ করে।
গ. উদ্দীপকের B মডেলের আলোকে X ও Y হলাে যথাক্রমে ২য় ও ৩য় শক্তিস্তর। অর্থাৎ n =2 এবং n = 3 বা যথাক্রমে L ও M শেল। নিচে L ও M শেলে অরবিটাল সংখ্যা ও ইলেকট্রন সংখ্যা হিসাব করা হলাে:
| শক্তিস্তর | উপস্তর | ইলেকট্রন সংখ্যা | ইলেকট্রন বিন্যাস। |
| L শেল | 2s 2p | 8 | 2s2 2p6 |
| M শেল | 3s 3p 3d | 18 | 3s2 3p6 3dl0 |
ঘ. উদ্দীপকের A মডেলটি ধনাত্মক নিউক্লিয়াস এবং তার চারপাশে ঘূর্ণনরত ঋণাত্মক ইলেকট্রন সম্পর্কে ধারণা দিচ্ছে। অপরদিকে, মডেল B অনুমোদিত কক্ষপথের ধারণা দেয়ার মাধ্যমে নিউক্লিয়াসের বাইরে ইলেকট্রন বিচরণের নির্দিষ্ট স্থান উল্লেখ করেছে। অর্থাৎ মডেল A মূলত রাদারফোর্ডের পরমাণু মডেল এবং মডেল B মূলত নীলস বোরের পরমাণু মডেলকে নির্দেশ করছে। নিম্নে মডেল দুটির তুলনামূলক আলোচনা করা হলো:
১. রাদারফোর্ড (A) এর মডেল ধারণা দেয় পরমাণুর কেন্দ্রে অবস্থিত ধনাত্মক নিউক্লিয়াস এবং তার চারপাশে থাকা ঋণাত্মক ইলেকট্রন এর অস্তিত্ব সম্পর্কে কিন্তু আবর্তনশীল ইলেকট্রন এর কক্ষপথের আকার ও আকৃতি সম্পর্কে A মডেলটি কোনো ধারণা দেয় না। অন্যদিকে বোর (B) মডেল কিছু অনুমােদিত বা স্থায়ী কক্ষপথের ধারণা দেয় যাতে ইলেকট্রনসমূহ কোনােরূপ শক্তি বিকিরণ না করে অনবরত ঘুরতে থাকে। এই কক্ষপথগুলোকে শক্তিস্তর বলে। মডেল B তে প্রদত্ত n =1, 2, 3 যথাক্রমে K, L, M ইত্যাদি শক্তিস্তরকে বোঝায়।
২. A মডেলটি একটিমাত্র ইলেকট্রন বিশিষ্ট পরমাণুর আকৃতি সম্পর্কে ধারণা দেয় যা মূলত হাইড্রোজেন। কিন্তু একাধিক ইলেকট্রন বিশিষ্ট পরমাণুতে ইলেকট্রনগুলো কীভাবে নিউক্লিয়াসকে পরিক্রমণ করবে তার কোনো ধারণা A মডেলে পাওয়া যায় না। কিন্তু B মডেলটি এ ত্রুটি দূর করে।
৩. A মডেলটি পরমাণুতে ইলেকট্রনের ঘূর্ণনকে সৌরজগতের সাথে তুলনা করেছে যা একটি বড় ভুল। কারণ সৌরজগতের গ্রহগুলো চার্জ নিরপেক্ষ হলেও ইলেকট্রনসমূহ চার্জ নিরপেক্ষ নয়। এগুলো ঋণাত্মক চার্জবিশিষ্ট। মডেল B, শক্তির বিকিরণ বিষয়ক মতবাদ উপস্থাপনের মাধ্যমে শক্তি শােষণ বা বর্জনে ইলেকট্রন এর নির্দিষ্ট কক্ষপথে বিচরণের ধারণাকে আরও স্পষ্ট করে।

